По полученным данным строят градуировочный график в координатах Е, МВ –pNO3.На оси абсцисс откладывают значение pNO3, на оси ординат Е, мв. Допустимое отклонение точек от прямой, характеризующей электродную функцию, не должно превышать ±6мв.
По графику определяется крутизна характеристики –число милливольт на единицу рNO3 –мв/рNO3. Крутизна электродной характеристики составляет 56,5+3,0 МВ/pNO3 при температуре 25ºс.
Откалиброванный электрод в паре с электрод сравнения готов к работе. Перед определением концентрации нитрат- ионов в исследуемых пробах проводят настройку прибора ЭВ-74 по двум растворам, соответствующим началу и концу измеряемого диапазона pNO3. После этого приступают к измерениям неизвестной концентрации нитратов в исследуемых образцах.
Подготовка пробы анализируемого образца: клубни картофеля, огурцы, капуста, свекла, томаты, фрукты, бахчевые культуры, зерно.
Анализируемыеобразцы овощей, фруктов, бахчевых культур измельчают на терке до размера частиц не более 1 см. Зерно измельчают на лабораторной электрической мельнице. К 1 г измельченного анализируемого образца приливают 50 мл 1% раствора алюмо–калиевых квасцов и гомогенизируют в течение 3 минут. (При отсутствии гомогенизатора проводят экстракцию на встряхивателе в течение 5 минут).
В полученную суспензию погружают электроды и измеряют Е, МВ. По градуировочному графику определяют pNO3-. Находят С(NO3-) моль/дм3
Рассчитывают содержание нитратов в мг/кг
Х=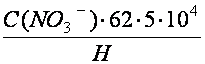 (мг/кг); где:
(мг/кг); где:
Н-навеска пробы, г.
Чувствительность метода 6мг/кг
По окончании работы электрод промывают в дистиллированной воде. Электрод ЭМ-NO3-01 хранят в растворе 0,1 KNO3. Если перерыв в работе составляет более 5 дней, электрод хранят на воздухе. Электрод сравнения хранят в дистиллированной воде.
К О Н Д У К Т О М Е Т Р И Я
Кондуктометрический метод анализа основан на измерении электрической проводимости (электропроводности) растворов электролитов.
Растворы электролитов обладают способностью проводить электрический ток под действием электрического поля. Двигающиеся в растворе ионы в поле электрического тока испытывают тормозящее действие со стороны молекул растворителя и окружающих противоположно заряженных ионов. Это так называемый релаксационный и электрофоретический эффекты. Результатом такого тормозящего действия является сопротивление раствора прохождению электрического тока. Электропроводность раствора W обратна его электрическому сопротивлению R:
W = ![]() (1)
(1)
где W – электропроводность раствора, Ом-1 или См (сименс),
R – электрическое сопротивление раствора, Ом
Для измерения электропроводности растворов
используются электроды, погруженные в этот раствор. Сопротивление раствора
обратно пропорционально площади электродов S (см2)
и прямо пропорционально расстоянию между ними ![]() (см):
(см):
R = ![]() (2)
(2)
где ![]() - коэффициент пропорциональности,
называемый удельным сопротивлением, Ом . см;
- коэффициент пропорциональности,
называемый удельным сопротивлением, Ом . см;
Если принять ![]() = 1 см, S = 1 см2, то R =
= 1 см, S = 1 см2, то R = ![]() . При этих условиях
удельное сопротивление равно сопротивлению 1 см3 раствора.
. При этих условиях
удельное сопротивление равно сопротивлению 1 см3 раствора.
В аналитических целях
величина “электропроводность – W” как таковая
используется крайне редко, поскольку электропроводность любого проводника –
раствора или металла – зависит от его размеров и форм. Чтобы не учитывать
зависимость электропроводности от размеров проводника, пользуются понятием
“удельная электропроводность ![]() ”. Удельная
электропроводность
”. Удельная
электропроводность ![]() (Ом-1 .
см-1 или См . см-1) является величиной, обратной
удельному сопротивлению:
(Ом-1 .
см-1 или См . см-1) является величиной, обратной
удельному сопротивлению:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.