Cr2O2-7 + 6J- + 14H+ → 2Cr3+ + 3J2 + 7H2O
![]() 1 Cr2O2-7
+ 14H+ + 6е → 2Cr3+
+ 3J2 + 7H2O
1 Cr2O2-7
+ 14H+ + 6е → 2Cr3+
+ 3J2 + 7H2O
3 2J- – 2e → J2
2S2O32- - 2e →S4O62-
J2 +2e→2J-
J2+2S2O32-→2J-+S4O62-
J2 +2Na2S2O3→2NaJ+Na2S4O6
Исходя из реакции (2) следует, что грамм-эквивалент тиосульфата натрия равен его молекулярной массе, т.е. 248,2.
При расчете концентрации титранта следует помнить, что взятое число мг-эквивалентов дихромата калия после реакции с иодидом калия выделяет равное количества мг-эквивалентов тиосульфата натрия, т.е.
![]()
![]()
N![]() . V
. V![]() = N
= N![]() . V
. V![]() = N
= N![]() . V
. V![]()
Исходя из этого соотношения, нормальность тиосульфата натрия вычисляют по формуле:
N![]() =
= 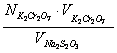
T![]() =
= ![]()
ЭМтиосульфата = Мол.масса Na2S2O3 · 5H2О = 248,2
3. Определение содержания Cu(II) в растворе медного купороса
Полученный в мерной колбе емкостью 100мл анализируемый раствор медного купороса CuSO4.5H2O разбавляют дистиллированной водой до метки и тщательно перемешивают.
В колбу для титрования пипеткой переносят 10мл раствора медного купороса, цилиндром туда же наливают 10мл 0,1 М раствора KY, 5мл 1м H2SO4 и, накрыв колбу часовым стеклом, ставят на 5 минут в затемненное место для завершения реакции.
Затем выделившийся иод титруют раствором тиосульфата натрия, не обращая внимания на осадок. Когда окраска раствора станет соломенно-желтой, прибавляют 10 капель крахмала и продолжают титровать до исчезновения синего цвета. Титрование повторяют 3 раза и из сходящихся результатов берут среднее значение.
Реакция идет по уравнению:
2CuSO4 +4KJ → 2CuJ+ J2 +2K2SO4
![]() 2
Cu2+ +ē→ Cu+
2
Cu2+ +ē→ Cu+
1 2J- - 2ē → J2
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.