![]()
![]()
![]()
м
Раствор и мембрана могут обмениваться одноименными ионами на обеих границах раздела. Если это только катионы водорода, то равновесиям
![]() и
и ![]() (1)
(1)
соответствуют скачки потенциала
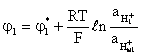 и
и  .
.
Потенциал мембранного электрода φм в целом
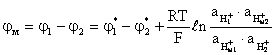 .
.
Если состав и концентрация раствора
(2)(так называемого внутреннего раствора) постоянны (![]() =
const) и мембрана симметрична (
=
const) и мембрана симметрична (![]() =
=![]() )
или стабильна (
)
или стабильна (![]() /
/![]() =const), то объединив константы в
=const), то объединив константы в ![]() , получим выражение:
, получим выражение:
![]() (2).
(2).
Из уравнения (2) следует, что мембранный электрод обладает функцией по соответствующим ионам раствора (1) и может быть для них индикаторным электродом.
Примером мембранного электрода является стеклянный, нашедший широкое применение для измерения рН и концентрации катионов щелочных металлов, а также Ag+, Tℓ+, NH4+. В равновесие (1) включаются катионы металла Ме+:
Нм+ + Мер+ ↔ Нр+ + Мем+ (3),
где индексами р и м обозначают раствор и мембрану, независимо от стороны. Можно показать, что потенциал стеклянного электрода φст
φст = φст*
+ ![]() , (4),
, (4),
где К – константа обмена равновесия (3), значение которой
зависит от сорта стекла (~10-10). Если ![]() ,
что справедливо для кислых и слабощелочных растворов вплоть до рН 10÷12, то
уравнение (4) упрощается до линейной зависимости потенциала стеклянного
электрода от рН раствора (внешнего)
,
что справедливо для кислых и слабощелочных растворов вплоть до рН 10÷12, то
уравнение (4) упрощается до линейной зависимости потенциала стеклянного
электрода от рН раствора (внешнего) ![]() ,
,
что показано на рис.6.
Если, наоборот, ![]() ,
то есть в щелочной области, то уравнение (4) упрощается до линейной зависимости
φст от р Ме+ и стеклянный электрод можно использовать в
качестве индикаторного электрода для определения активности катионов металла.
,
то есть в щелочной области, то уравнение (4) упрощается до линейной зависимости
φст от р Ме+ и стеклянный электрод можно использовать в
качестве индикаторного электрода для определения активности катионов металла.
![]()
![]() φст
φст
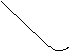 |
|||
0 6 12 рН
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.