nщ.к. = n![]()
Nщ.к. ·Vщ.к.
= N![]() · V
· V![]()
N![]() =
=
![]() ; Т
; Т![]() =
=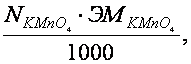 г/мл.
г/мл.
ЭМ![]() =
=![]()
3. Определение содержания железа (II) в растворе соли Мора
Полученный в мерной колбе на 100 мл анализируемый раствор соли Мора FeSO4(NH4)2SO4 · 6H2O (задача) разбавляют дистиллированной водой до метки и тщательно перемешивают. В три конические колбы отбирают пипеткой по 10 мл анализируемого раствора и добавляют мензуркой по 10 мл 4 н. H2SO4. Полученную смесь перемешивают и титруют раствором перманганата калия до бледно – розового окрашивания. Для вычисления берут среднее значение объема титранта, пошедшего на титрование.
Реакция идет по следующему уравнению:
10FeSO4 + 2KMnO4 + 8H2SO4 → 2MnSO4 +5Fe2(SO4)3 + K2SO4 + 8H2O
![]() 5 Fe2+ – 1e → Fe3+
5 Fe2+ – 1e → Fe3+
1 MnO-4 + 8H+ + 5e → Mn2+ + 4H2O
MnO-4 + 5Fe2+ + 8H+ → Mn2+ + 5Fe3+ + 4H2O
Отсюда следует, что грамм – эквивалент соли Мора равен ее молекулярной массе.
По результатам титрования рассчитывают концентрацию анализируемого раствора и количество железа (II) в выданном растворе (100 мл) по следующим формулам:
nсоли Мора = n![]()
Nсоли Мора . Vсоли
Мора = N![]() .
V
.
V![]()
QFe(II) = Nсоли Мора . Vк . ЭМFe , (мг)
где QFe(II) – содержание определяемого вещества, мг;
ЭМ – грамм – эквивалент железа
Vк– объем мерной колбы, мл.
ИОДОМЕТРИЯ
Основная реакция: J2 + 2e ↔ 2J-
|
Первичный стандарт-ный раствор исходного вещества |
K2Cr2O7 – дихромат калия; 0,02 н. раствор Cr2O72- + 6e + 14H+ → 2Cr3+ + 7H2O E° ЭМ = |
|
Вторичные стандартные растворы |
1.) Na2S2O3 · 5H2O – тиосульфат натрия; ~ 0,02 н. раствор 2S2O2-3
– 2e → S4O62-; E° ЭМ = 2.) J2 – иод, 0,02 н. раствор Е° |
|
KJ – иодид калия; 0,1 М раствор KJ – вспомогательный раствор |
|
|
Фиксирование точки эквивалент-ности (ТЭ) |
Специфический индикатор – крахмал, 5% - ный раствор Образует с иодом сине – черное окрашивание |
|
Определяемые вещества |
1.) Окислители. Определяют методом замещения n K2Cr2O7 + 6KJ+ 7H2SO4 → Cr2(SO4)3 + 3J2 + 4K2SO4 + 7H2O J2 + 2Na2S2O3 → 2NaJ + Na2S4O6 3.) Восстановители. Определяют обратным титрования
Na2SO3 + J2 + H2O → 2HJ + Na2SO4 избыток J2 + 2Na2S2O3 → 2NaJ + Na2S4O6 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.