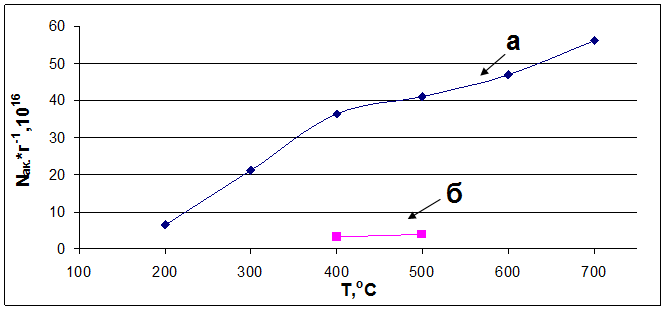
Рис. 6.2. Влияние температуры предварительной обработки образцов на количество детектируемых электроноакцепторных центров, определенных по разработанной (а) и существующей (б) методикам.
В результате проведенных исследований были выбраны оптимальные условия определения концентрации электроноакцепторных центров (включая слабые), позволяющие с хорошей воспроизводимостью (погрешность эксперимента в пределах 10%) и минимальными усилиями получать более полную информацию о поверхностной кислотности. Оптимальными условиями определения кислотности индивидуальных и модифицированных оксидов алюминия следует считать:
· Дегидратация катализаторов на воздухе при 400°C перед проведением экспериментов.
· Использование в качестве зонда радикалов, возникающие при адсорбции электронодонорных молекул антрацена
· Концентрация антрацена в толуоле 4х10–2М.
· Время выдержки образцов в растворе - 12 часов при 80°C.
6.2. Применение новой методики определения электроноакцепторных центров (включая слабые) при исследовании модифицирующих добавок (SO42-, Cl-, Na+) на кислотные и каталитические свойства оксидов алюминия.
Разработка новой методики, позволяющей определять не только сильные, но и слабые электроноакцепторные центры позволила нам получить более полную информацию о влиянии хлорид и сульфат ионов, а также примесей катионов натрия на кислотно-основные свойства модифицированных оксидов алюминия.
Было установлено, что при введении хлорид ионов к оксиду алюминия суммарная концентрация сильных и слабых электроноакцепторных центров сначала резко возрастает, а затем наблюдается плавный, практически линейный рост концентрации электроноакцепторных центров с увеличением количества вводимых Cl- до 4 масс. %. Поведение же сильных акцеторных центров отличается, их концентрация практически линейно растет с увеличением количества вводимых хлорид ионов. Из рисунка 6.3 видно, что применение новой методики позволяет увеличить количество обнаруживаемых центров примерно в 5-10 раз. Это, как будет показано ниже, позволяет повысить достоверность корреляций каталитической активности с кислотно-основными свойствами. Концентрация электронодонорных центров при введении хлорид ионов сначала линейно уменьшается, а затем выходит на плато.
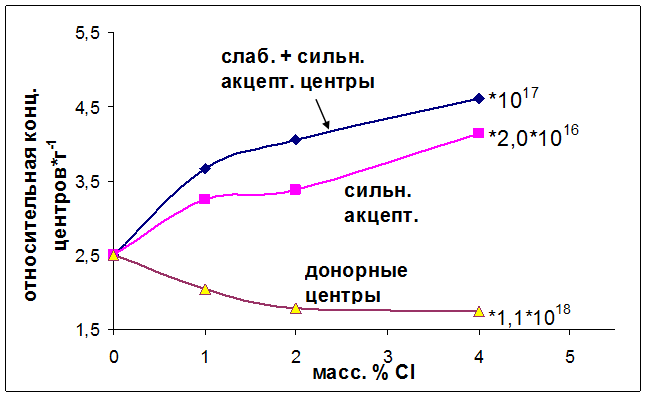
Рис. 6.3. Влияние концентрации Cl- на количество детектируемых электроноакцепторных и электронодонорных центров.
Другая зависимость наблюдается при введении в оксиды алюминия сульфат ионов. Здесь мы видим (Рис. 6.4), что суммарная концентрация сильных и слабых электроноакцепторных центров линейно возрастает при увеличении количества вводимых сульфат ионов и даже небольшие добавки сульфат ионов приводили к резкому увеличению концентрации детектируемых электроноакцепторных центров (включая слабые). Концентрация же сильных электроноакцепторных центров практически не изменяется до введения 4 масс. % SO42-, а затем при увеличении количества SO42- до 8 масс. % возрастает примерно в 2 раза. В данном случае количество обнаруживаемых центров увеличивается почти в 10 раз. Концентрация электронодонорных центров линейно уменьшалась с увеличением количества вводимых сульфат ионов.
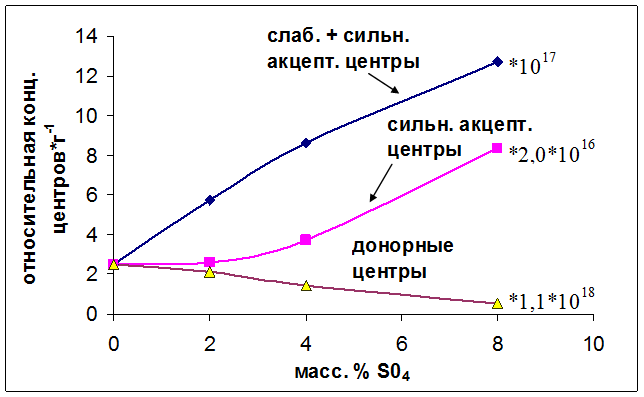
Рис. 6.4. Влияние концентрации SO42- на количество детектируемых электроноакцепторных и электронодонорных центров.
Нами была получена линейная корреляционная зависимость между суммарной концентрацией слабых и сильных электроноакцепторных центров и скоростью образования этилена с фактором достоверности 0,96 (Рис. 6.5). В отличие от зависимости, которая была получены нами для сильных электроноакцепторных центров (Рис. 6.6), в данном случае аппроксимирующая прямая проходит через начало координат, а также нет выпадающих точек (2 и 4 масс. % SO42-), что свидетельствует о том, что более слабые электроноакцепторные центры играют существенную, а может быть и определяющую роль, в реакции дегидратации спиртов. Также, новые экспериментальные данные по концентрации электроноакцепторных центров (включая слабые) (Рис. 6.3 и 6.5), подтверждают предположение сделанное в разделе 5.3., что выпадения точек 2 и 4 масс. % SO42- из корреляционной зависимости, полученной для сильных электроноакцепторных центров (Рис. 6.6) объясняется тем, что при введении SO42- до 4 масс. % возрастает концентрация слабых электроноакцепторных центров, в то время как концентрация сильных центров практически не меняется.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.