Гидролиз образцов проводился в различных условиях. В качестве гидролизующих агентов использовали растворы - 0.1М HCl, H2O, 1 масс. % раствор NH4Cl и 0.5 масс. % раствор NH3. Стехиометрическое отношение алкоголята алюминия и гидролизующего агента варьировалась от 0 до 1 (в дальнейшем степень гидролиза).
Попытка изучения кинетики гидролиза алкоголята алюминия не удалась. Независимо от выбора условий, гидролиз шел быстро, практически с моментальным образованием достаточного крупных коагулятов алюминия, которые методом ЯМР обнаружить нельзя. И в дальнейшем в растворе уже никаких изменений не происходило. Все последующие процессы шли в образовавшемся геле.
Варьируя степень гидролиза для 0,3М раствор триизопропилата алюминия в изопропиловом спирте от 0 до 1 (для этого добавляли расчитанное количество воды, которое соответствует определенной степени гидролиза триизопропилата алюминия), мы не наблюдали новых форм алюминия (Рис. 4.9). Менялось только абсолютная интенсивность описанных выше форм, относительная же оставалась примерно одинаковой (Рис. 4.10). Логично было бы предположить, что скорость гидролиза разных форм должна быть различной и относительная интенсивность их на разных стадиях гидролиза должна меняться, но, как видно из спектров, она сохраняется на каждом этапе гидролиза. Значит, между этими формами существует равновесие, которое устанавливается, быстрее, чем идет гидролиз, либо все три алкоксидных группы замещаются на гидроксильные группы практически одновременно.
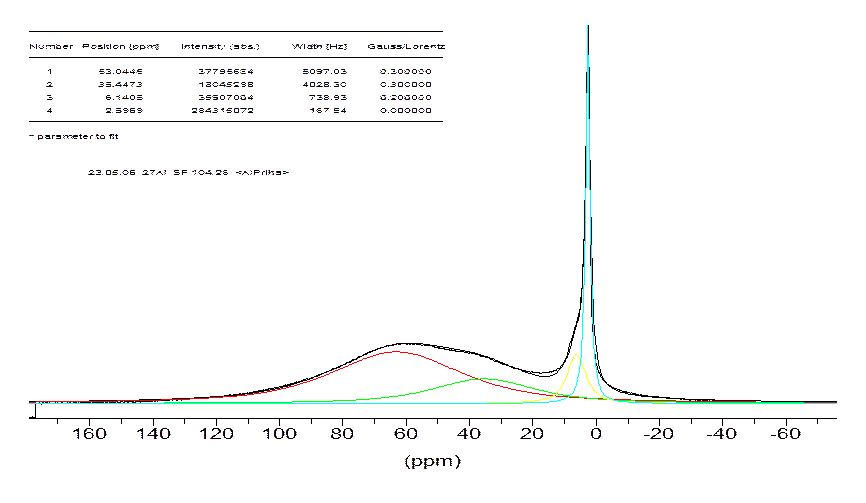
Рис. 4.9. Спектр ЯМР 27Al 0,3М раствор триизопропилата алюминия, к которому добавлено 0,5 экв. Н2О.
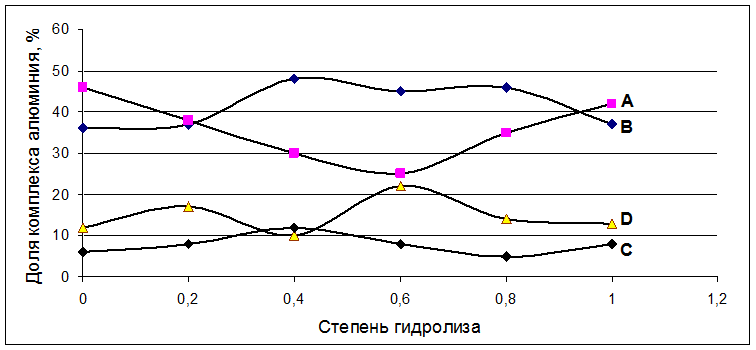
Рис. 4.10. Доли комплексов алюминия в растворе триизопропилата алюминия при различных степенях гидролиза (степень гидролиза рассчитывались по количеству добавленной воды).
Где А – тетракоординированный алюминий, В – пентакоординированный алюминий, С – димер гексакоодинированного алюминия и D – гексакоординированный алюминий.
Проведенные исследования показали несостоятельность приведенных в литературе схем гидролиза алкоголята алюминия, которые являются слишком упрощенными вариантов тех процессов, которые происходят при гидролизе. И они не отражают тех реальных химических превращений, которые протекают при гидролизе алкоголятов алюминия. Этот процесс нуждается в дальнейших исследованиях, и основной упор нужно сделать на изучение изменений, происходящих во влажном геле.
4.2.3. Изучение динамики процесса старения гидроксида алюминия методом МУРР.
Следующей стадией, влияющей на формирование гидроксидов, является стадия старения. В разделе 4.1 (Табл. 4.2) было показано, что выбор гидролизующего агента влияет на соотношение аморфной фазы и псевдобемита, а также на кристаллическую структуру полученных псевдобемитов. Поэтому большой интерес, представляло изучение динамики процессов, происходящих при старении полученного осадка гидрокида алюминия, во времени и влияние на него различных гидролизующих агентов. В качестве гидролизующих агентов были выбраны – 0.1M раствор соляной кислоты HCl, дистиллированная вода, 1 масс. % раствор хлорида аммония NH4Cl и 0.5 масс. % раствор аммиака NH3.
Как и в случае раствора, характер приведенных рентгенограмм МУРР для полученных осадков гидроксидов алюминия (Рис. 4.11. – 4.14.) показал, что в первом приближении можно использовать форм-факторы близкие к однородным равноосным наночастицам (отношение осей не более, чем 1:3). Структурными моделями таких частиц могут являться однородные сферы [184]. Каждая рентгенограмма на рисунках соответствует определенному времени старения гидроксида алюминия под маточным раствором от 5 мин (нижняя кривая) до 2,5 часов (верхняя кривая). Методика эксперимента не позволяла получить рентгенограммы, для гидроксидов алюминия с меньшим временем старения. Для осадков гидроксидов алюминия, полученных гидролизом раствора соляной кислоты и водой, интервал между съемкой ренгенограмм составлял 50 минут, а для осадков, полученных раствором хлорида аммония и аммиака примерно 18 минут.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.