Каталитическая активность особо чистых модифицированных (Si, Zr, Ti) алюмооксидных катализаторов, полученных по алкоголятной технологии (Глава 4) была исследована в реакции дегидратации н-бутанола.
Каталитическая активность индивидуальных и модифицированных оксидов алюминия, полученных методами переосаждения (ВГО-1, A1) или гидратацией продуктов термической активации гидраргилита (АОК-63-22) с последующей пропиткой сформованных гидроксидов или оксидов алюминия растворами модифицирующих соединений, была исследована в реакции дегидратации этанола.
5.1.1. Исследование влияния добавок Э4+ (Si, Ti, Zr) на каталитическую активность особо чистых оксидов алюминия в реакции дегидратации н-бутанола.
Как было описано в разделе 4.2., былиполучены две серии
модифицированных (Si, Ti, Zr) особо чистых оксидов алюминия. В первой, мольное
соотношение Al/Э(IV) составляло
≈ 64/1, во второй количество вводимого Э(IV) четырех
валентного элемента было увеличено в 1.5 раза и составило Al/Э(IV) ≈ 42/1. Каталитическая активность модифицированных особо
чистых оксидов алюминия была исследована на примере реакции дегидратации
н-бутанола. Во всех случаях определялась удельная скорость образования
бутиленов - [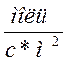 ].
].
Было изучено температурная зависимость скорости образования бутиленов (Рис. 5.1 – 5.6) и определена энергия активации для каждого из образцов (Табл. 5.1).
Для первой серии образцов, наибольшая удельная каталитическая активность наблюдалась у оксида алюминия с добавкой циркония (Рис. 5.3). Для титана же она была несколько ниже, чем у индивидуального оксида алюминия (Рис. 5.5), но так как введение титана приводило к увеличению величины поверхности, то активность, отнесенная к одному грамму катализатора, была выше, чем у индивидуального оксида алюминия. Оксид алюминия с добавкой кремния при более низких температурах показал меньшую удельную каталитическую активность, чем индивидуального оксида алюминия, но при повышении температуры его активность возрастала быстрее и начиная с 285°С его удельная активность становится выше, чем у индивидуального оксида алюминия (Рис. 5.1).
Во второй серии образцов, с увеличенным содержанием вводимых Э(IV) в 1.5 раза, все модифицированные оксиды показали удельную каталитическую активность, которая в 1.5-2 раза превышала активность индивидуального оксида алюминия (Рис. 5.2, 5.4 и 5.6).
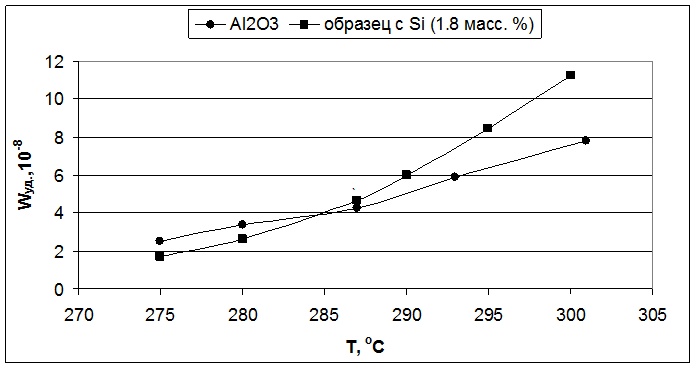
Рис. 5.1. Влияние температуры реакции на удельную скорость образования бутиленов (образцы – Al2O3 и 1,8 масс. % SiO2/Al2O3).
Где, W - скорость, выраженная в единицах W[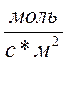 ]
]
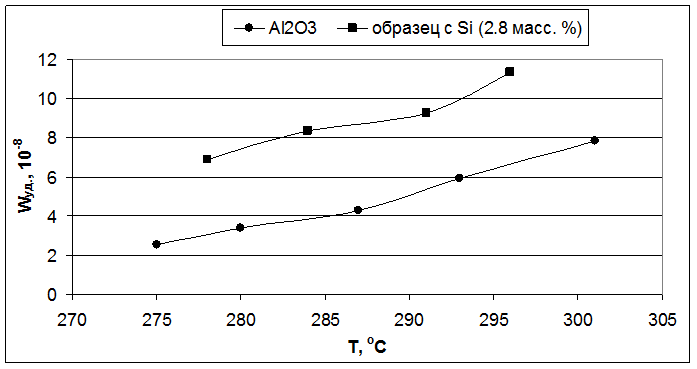
Рис. 5.2. Влияние температуры реакции на удельную скорость образования бутиленов (образцы – Al2O3 и 2,8 масс. % SiO2/Al2O3).
Где, W - скорость, выраженная в единицах W[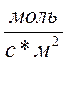 ]
]
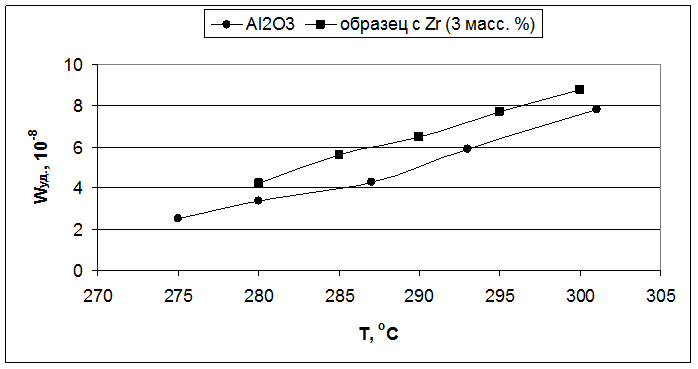
Рис. 5.3. Влияние температуры реакции на удельную скорость образования бутиленов (образцы – Al2O3 и 3,0 масс. % ZrO2/Al2O3).
Где, W - скорость, выраженная в единицах W[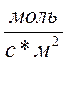 ]
]
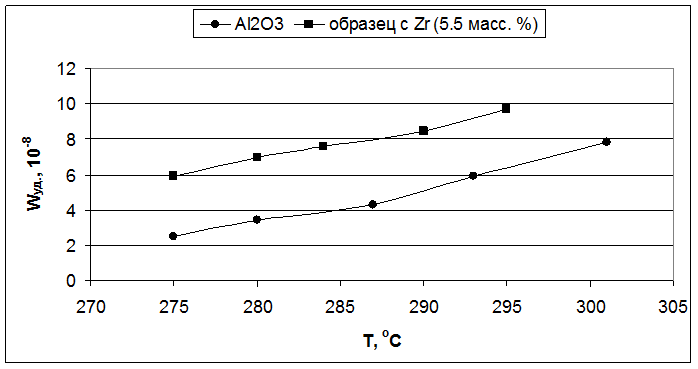
Рис. 5.4. Влияние температуры реакции на удельную скорость образования бутиленов (образцы – Al2O3 и 5,5 масс. % ZrO2/Al2O3).
Где, W - скорость, выраженная в единицах W[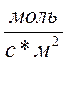 ]
]
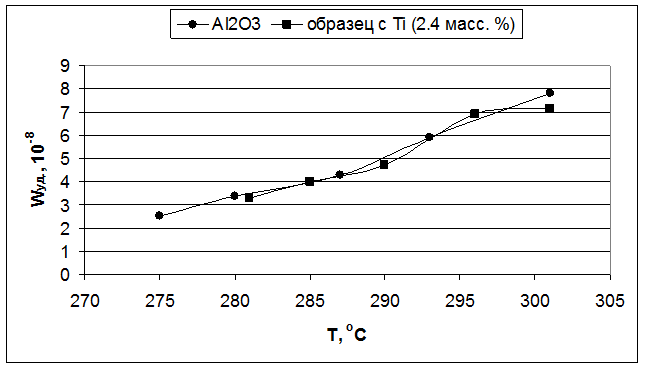
Рис. 5.5. Влияние температуры реакции на удельную скорость образования бутиленов (образцы – Al2O3 и 2,4 масс. % TiO2/Al2O3).
Где, W - скорость, выраженная в единицах W[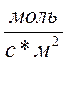 ]
]
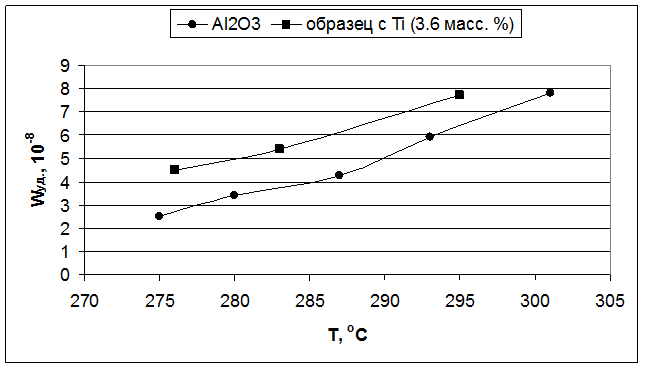
Рис. 5.6. Влияние температуры реакции на удельную скорость образования бутиленов (образцы – Al2O3 и 3.6 масс. % TiO2/Al2O3).
Где, W - скорость, выраженная в единицах W[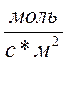 ]
]
На основании экспериментальных данных (Рис. 5.1 – 5.6), были построены графики зависимости удельной скорости образования бутиленов от времени в Аррениусовских координатах (Рис. 5.7) и вычислены значения энергии активации для всех исследуемых модифицированных оксидов алюминия, а также индивидуального оксида алюминия (Табл. 5.1). Установлено, что энергия активации для исследуемых образцов увеличивается в следующем порядке – ZrO2 (5.5 масс. %)<SiO2 (2.8 масс. %)<TiO2 (3.6 мас %)<ZrO2 (3.0 масс. %)<TiO2 (2.4 масс. %)<Al2O3 (Табл. 5.1). Эти данные говорят о положительном влияние добавок. У образца с кремнием (1.8 масс. %) энергия активации примерно в 1.7 раз больше, чем у индивидуального оксида алюминия, и сильно отличается предэкспоненциальный множитель. Для индивидуального оксида алюминия lnk=7, а для оксида алюминия с добавкой 1.6 масс. % Si lnk=26. Причины этого более детально не исследовались.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.