Исходя из имеющихся литературных данных, можно сформулировать следующие требования, предъявляемые к зондам: адсорбция зонда не должна приводить к необратимым изменениям поверхности; зонд должен специфично взаимодействовать с кислотными и основными центрами; при адсорбции зонда не должны проявляться стерические препятствия.
Как было выше сказано, сила и концентрация кислотных центров твердого катализатора определяется по отношению к их взаимодействию с основаниями и может быть определена по химической адсорбции соответствующего основания или из изменения окраски соответствующего основного индикатора. С этой точки зрения Бренстедовская кислотность выражается в способности материала передавать протон, по крайней мере, частично, а Льюисовская кислотность – в способности принимать электронную пару с образованием координационной связи. При исследовании свойств любого твердого кислотного катализатора встают вопросы: кислотные центры какого типа присутствуют на поверхности, какова их сила и количество. И наоборот, при поиске оптимального катализатора для того или иного процесса важно знать кислотные центры какого типа и какой силы необходимы для его протекания.
Как отмечалось в литературном обзоре, уже в первых публикациях, посвященных изучению процесса дегидратации спиртов [77,101], исследователи связывали активность катализаторов с их кислотными свойствами. Было показано, что наличие сильных кислотных центров [130-132] приводит к увеличению конверсии спиртов. При этом максимальная скорость дегидратации спиртов достигается, когда отношение Бренстедовских кислотных центров к Льюисвоским кислотным центрам максимально Б./Л. = max. [101]. Но более важным фактором, определяющем скорость реакции дегидратации, скорее является концентрации кислотных центров, чем их сила [85].
Ниже будут кратко описаны методы определения поверхностной кислотности, которые в последние время применяются при исследовании процессов дегидратации.
А) Потенциометрическое титрование
Общая кислотность катализаторов можно определять по методу потенциометрического титрования н-бутиламина. По этой методике [119] катализатор нагревают в вакууме, затем добавляют раствор бутиламина в ацетонитриле и перемешивают в течение 3 часов. После этого оттитровывают полученную суспензию с одинаковой скоростью 0,1 мл/мин. Изменение электродного потенциала фиксируется с помощью потенциометра Orio 420 digital A.
Б) термодесорбционные методы
Адсорбция летучих оснований, прежде всего аммиака, пиридина, и других аминов, с последующей их десорбцией при нагревании часто используется для определения количества и силы кислотных центров на поверхности твердых катализаторов. Температура десорбции говорит о силе кислотных центров образцов. Чем выше температура десорбции, тем сильнее центры. Концентрация кислотных центров измеряется по интегральной интенсивности полос адсорбированного аммиака.
Метод термической десорбции интенсивно применялся при изучении кислотности модифицированных оксидов алюминия, цеолитов [84,102,151] и сульфатированных оксидов циркония [123]. Но при изучении сульфатированных оксидов циркония в большинстве случаев, однако, наблюдалась необратимая адсорбция оснований с последующим разложением адсорбированных частиц при высоких температурах.
Berteau and Delmon предложили качественную [151] классификацию кислотных центров на слабые (Тдесорб.=20-200оС), промежуточные (Тдесорб. = 200-400) и сильные (Тдесорб.> 400 оС). На примере модифицированных оксидов алюминия, они показали, что по этой классификации, катализаторы с промежуточными кислотными центрами имеет относительно более высокую активность в реакции дегидратации спиртов, в то время как слабые кислотные центры не активны.
Zhang et al. [102] использовали метод термопрограмированной десорбции аммиака для сравнения кислотных свойств чистого оксида алюминия и трех типов цеолитов(Рис. 1.10).
. 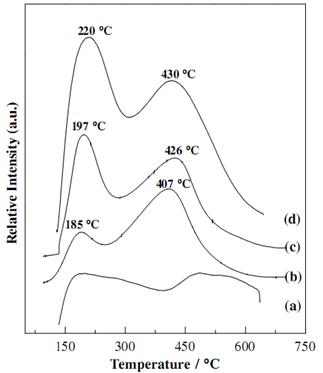
Рис. 1.10. NH3-TPD профили образцов (а) Al2O3 (b) SAPO-34 (c) NiAPSO-34 и (d) H-ZSM-5 [102].
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.