*Концентрация ФГ в 10-5 моль на 1г сибунита.
Как показано на Рис. 3.3 введение модифицирующих добавок не привело к положительным результатам по выходу легких олефиновых углеводородов. Некоторые системы, например, сибуниты с нанесенными КФ и введенными добавками металлов II и IV групп можно рассматривать как основу для разработки катализаторов получения синтез-газа. Но перед нами такая задача не ставилась.
Проведены также эксперименты по влиянию различных добавок к метанолу, с помощью которых пытались сместить термодинамическое равновесие: вода, метан, ДМЭ, водород, аргон. Пытались получить дополнительные продукты введением, например, этилена. Эксперименты показали, что реакционная система кинетически чрезвычайно чувствительна к любым добавкам. Они влияли на степень превращения и на распределение продуктов, но только в рамках, благоприятных по термодинамике. То есть основными продуктами являлись метан, этан, водород и СОх. При больших степенях превращения увеличивается вклад парового риформинга с образующейся водой: увеличивается выход водорода и оксидов углерода.
Таким образом, нам не удалось получить положительные результаты по получению легких олефинов с использованием сибунита.
3.1.2. Катализаторы на основе оксида алюминия.
Более интересным оказался оксид алюминия марки А1. Высушенный, а затем прокаленный при 550oС оксид алюминия использовали как носитель. Активные добавки вводили методом пропитки по влагоёмкости.
Лучшие результаты по выходу олефинов были получены при конверсии метанола на катализаторе фосформолибденовая ГПК (24 масс. % Mo/Al2O3) нанесенная на оксид алюминия. При Т= 400оС и времени контакта 2 с выход продуктов составлял: метан - 10 мол. %; этан – 12,5; пропан – 2,4; этилен – 5,3; пропилен -3,2; бутен – 2,5; водород 21; СОх -12; ДМЭ -30, остальное – кокс.
Но и эти результаты получаются только на свежем катализаторе, быстро происходит его дезактивация, и далее получаются только парафины С1-С4 , оксиды углерода и водород в соответствии с термодинамикой (Рис. 3.4). По данным РФА (Рис. 3.5), ИКС и КР гетерополикислота остается без изменений, только появляется углерод, который не выжигается при регенерации. Возможно, он и закрывает доступ к активным центрам внутри полостей ГПК, ведущим синтез олефинов. При больших степенях превращения происходит дополнительная паровая конверсия метанола с образующимся водяным паром, что приводит к увеличению содержания водорода и диоксида углерода в продуктах. Модификация этого катализатора оксидами цинка, церия, иттрия, циркония не приводила к улучшению результатов или же снижала выход олефинов до следовых количеств.
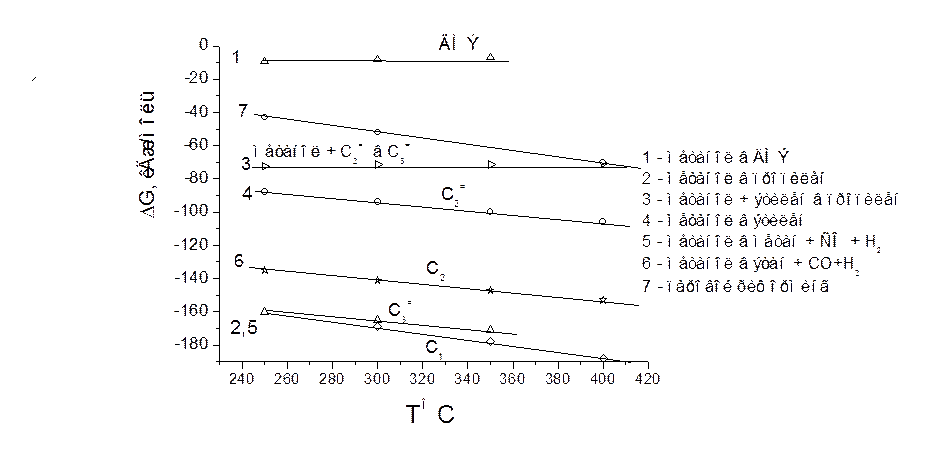
Рис. 3.4. Значения потенциала Гиббса для получения разных продуктов из метанола.
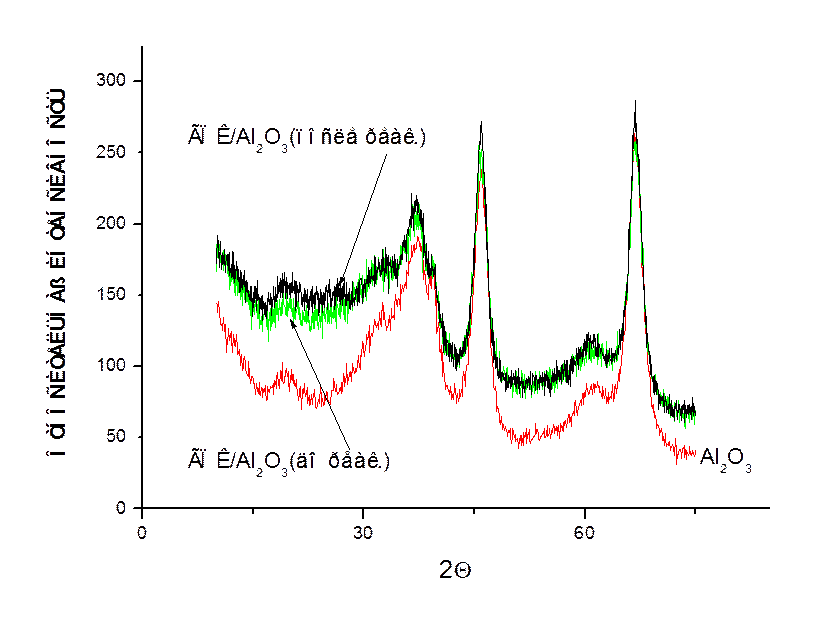
Рис. 3.5. Рентгенограммы исходного оксида алюминия и образца фосформолибденовая кислота на оксиде алюминия до и после проведения МТО процесса.
Таким образом, полученные на оксиде алюминия результаты по получению олефинов из метанола не представляют практического интереса. Можно сделать вывод, что для активации метанола важны не столько диаметр пор, сколько их форма. По крайней мере, на гетерополикислоте, которая имеет поры по форме, близкие к сферической, метанол активируется.
На Рис. 3.4 показана зависимость потенциалов Гиббса для разных реакций метанола от температуры, при которой проводились испытания. По термодинамике выход парафинов С1, С2 более выгоден, чем, например этилена. Но когда имеется такой широкий спектр возможных продуктов, все определяет кинетика.
В промышленности конверсия метанола в ДМЭ на оксидах алюминия составляет примерно 60 моль. %. Нами получен более высокий выход 85 моль %, что очень близко к термодинамическому равновесию при данных температурах реакции. В таблице 3.3 приведен состав газовой смеси при разных температурах на катализаторе кремнийвольфрамовая ГПК/Al2O3 (30 масс. % W/Al2O3). Этот катализатор испытывали для получения олефинов, но получили хороший выход ДМЭ. Хотя ДМЭ менее термодинамически выгоден, чем синтез парафинов, СО, CO2 и водорода, очевидно, что кинетика в данном случае благоприятствует именно ему. Расход метанола 4 мл/час на 1 г катализатора. Степень превращения метанола в ДМЭ близка к 99%. Оптимальная температура 280оС. Процесс требует регенерации.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.