Известно, что dq = с dT= cu dT+ р du или (с- cu )dT+ р du = 0.
Здесь с - теплоемкость политропного процесса, который является общим для всех изопроцессов. Политропным называют любой процесс в идеальном газе с постоянной теплоемкостью. Дифференцируя уравнение Клапейрона, можно получить, что
![]()
Тогда
![]()
Так как R = сp - cu , то поделив последнее уравнение на (cu - с) рu, получим
(сp - с) du /(cu - с ) u + dр/р = 0.
Обозначив (сp - с) /(cu - с ) = n — показатель политропы, после интегрирования получим, что
р u n =const. (11.10)
В изохорных процессах (u = const) показатель политропы n= ± ¥, а для изобарных (р = const п = 0. Для изотермических (Т = const) процессов п = 1, а для адиабатных (q=0) процессов п = k = ср/сu.
Из (11.10) имеем:
![]()
В соответствии с уравнением Клапейрона (T2/T1) = (р2 u2 )/ (р1 u1 ). При совместном рассмотрении обоих уравнений получим:
![]()
Для различных значений показателя политропы, т. е. для разных процессов, уравнение (11.11) можно, преобразовать следующим образом:
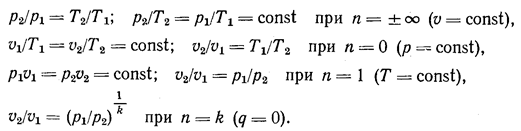
Первые две зависимости u =f(/р) на графике (рис. 5) изображены прямыми линиями, а последние — кривыми. Видно, что адиабата круче изотермы. Все процессы, кривые которых левее вертикали, проходящей через точку А, соответствуют сжатию газа, а правее — расширению. Линия n = k делит поле диаграммы на две части. Выше ее протекают процессы с подводом теплоты, а ниже — с отводом.
Изменение энтропии в процессах ds = (du/Т) + (рdu)/Т. Поэтому
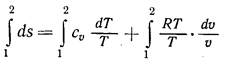
или
![]()
В зависимости от характера процесса будет меняться расчетный вид этого уравнения для определения изменения энтропии:
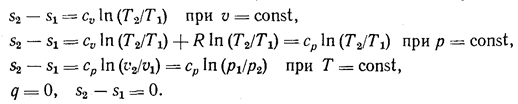
Характер изменения энтропии в этих процессах изображен на рис. 6. Видно, что при осуществлении изохорного и изобарного процессов в одном температурном интервале изменение энтропии будет больше в изобарном процессе, так как ср > сu
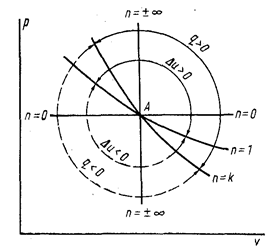
Рис. 5. Диаграмма политропных процессов в координатах рu
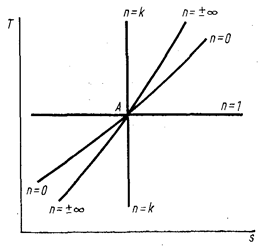
Рис. 6. Диаграмма политропных процессов в координатах Ts
Величина работы процесса
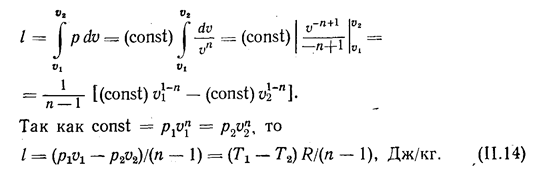
Подставляя в это уравнение различные значения n, кроме n=1, получим расчетные уравнения для работы газа в разных процессах:
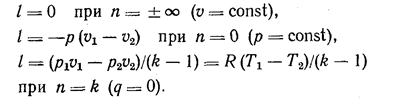
При п = 1 уравнение для работы можно получить интегрированием уравнения (11.10):
![]()
при T=const. Теплота политропного процесса
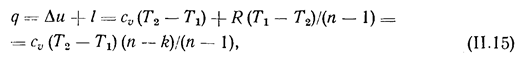
где сu (n -k)/(n - 1) — теплоемкость политропного процесса, в зависимости от n меняющаяся от -¥ до + ¥. Величина q имеет значения:
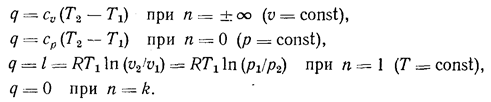
3. Водяной пар
Водяной пар широко применяют в теплотехнике. Пар может быть получен испарением и кипением воды. Испарение — процесс парообразования с открытой поверхности воды. При кипении процесс парообразования осуществляется во всем объеме воды при достижении температуры кипения ts. С изменением давления среды температура кипения изменяется. Так, при атмосферном давлении температура кипения воды равна 100°С. С повышением давления до 16 105 и 85 105Па она повышается соответственно до 200 и 300° С.
Процесс образования пара при кипении воды можно подразделить на три стадии: подогрев воды до температуры кипения, парообразование и перегрев пара. Этот процесс можно наглядно изобразить с помощью графика в координатах рu (рис. 7). Стадия подогрева воды сопровождается небольшим увеличением ее объема; ей соответствует участок ab. Стадия кипения (парообразования) характеризуется участком bс и последняя стадия прямой сd.
При кипении воды образуется влажный насыщенный пар, имеющий температуру кипения ts Насыщенным называют пар, находящийся в термодинамическом равновесии с жидкостью. Во влажном паре находятся мельчайшие частички жидкости. Следовательно, он представляет собой двухфазную систему. Поэтому массовую долю сухого пара называют степенью сухости и обозначают через х, а долю воды во влажном паре, равную (1 — х), называют степенью влажности. Графически степень сухости пара в какой-либо точке может быть определена по отношению отрезков bx/bс. При полном превращении воды в пар он станет сухим насыщенным. Параметры сухого пара характеризуются точкой с. При дальнейшем подводе теплоты сухой, пар будет превращаться в перегретый (линия cd), имеющий температуру tпер выше температуры кипения воды ts. Разность (tпер - ts ) называют степенью перегрева пара.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.