1. В ампулу помещают 0,6 мл раствора, содержащего Ni(acac)2 (0,01 моль/л) и пиридин (1,0 моль/л) в СDCl3.
2 Регистрируют спектры ЯМР приготовленного раствора при температурах от 30 до 70 °С через каждые 5 °C.
3. Определяют парамагнитные сдвиги a‑протона пиридина по разнице химических сдвигов a‑протона пиридина в присутствии и в отсутствии Ni(acac)2Py2.
4. Строят
графики зависимости ![]() от обратной температуры.
от обратной температуры.
5. Определяют ширину линии a‑протона пиридина для каждой температуры. Данные заносят в таблицу:
|
T, К |
1/T |
|
ln |
6. Строят
график зависимости ln![]() = f(1/T).
= f(1/T).
7. Из графика определяют анергию активации обмена и время обмена, а также ошибки полученных величин по МНК.
ЛАБОРАТОРНАЯ РАБОТА Я-6
Определение энергии активации заторможенного вращения метиленовых групп в диметилформамиде
При комнатной температуре в спектре 1H ЯМР диметилформамида наблюдается два сигнала от неэквивалентных метильных групп (Рисунок 18). При повышении температуры от 20 до 150 °С ускоряется заторможенное вращение вокруг С–N связи, в результате вращения метильные группы меняются местами, а следовательно, и химическими сдвигами. При этом наблюдается картина изменения спектра с температурой, аналогичная изображенной на Рисунке 14.
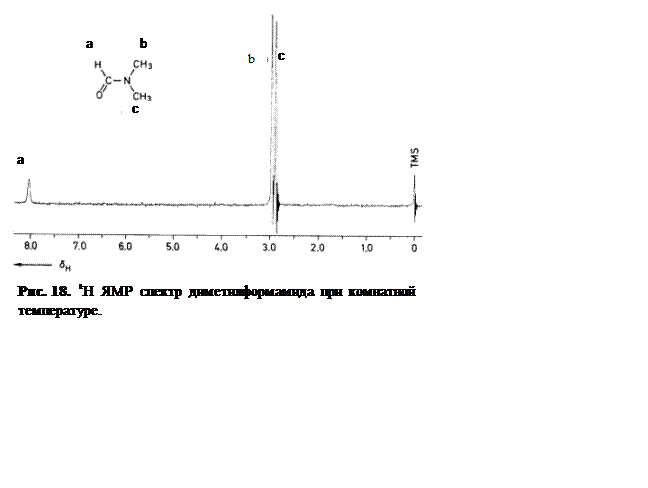
Оценку значения tA, характерного времени заторможенного вращения, при различных температурах можно произвести по формуле (4.60), переписав ее в более удобном виде
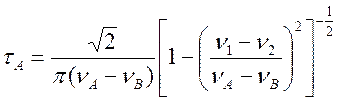 (9.22)
(9.22)
где nА и nВ – частоты наблюдаемых линий (Гц) в отсутствии обмена,
n1 и n2 – частоты тех же линий в экспериментальном спектре. Построив зависимость ln(1/tA) от 1/Т, можно определить энергию активации Е заторможенного вращения.
Методика выполнения эксперимента
1. В 5 мм ампулу ЯМР помещают 0,6 мл диметилформамида и добавляют 5% объемных эталона ГМДС. Ампулу необходимо плотно закрыть или запаять.
2. Записывают
спектр ЯМР диметилформамида при 20 °С
для определения ![]() .
.
3. Выбирают
диапазон температур (100‑150 °С), в котором наиболее заметно изменение
расстояния между сигналами метильных групп с температурой ![]() .
.
4. Воспользовавшись
для определения характерного времени заторможенного обмена ![]() формулой (9.22), строят зависимость ln(1/tA) от 1/Т. Шаг в изменении температуры 5 °С. Из получающейся в результате прямой по МНК
(выражения (9.4)‑(9.6)) определяют величину энергии активации заторможенного
вращения E.
формулой (9.22), строят зависимость ln(1/tA) от 1/Т. Шаг в изменении температуры 5 °С. Из получающейся в результате прямой по МНК
(выражения (9.4)‑(9.6)) определяют величину энергии активации заторможенного
вращения E.
ВОПРОСЫ ДЛЯ КОЛЛОКВИУМА
1. Понятие о ядерном магнитном резонансе.
2. Блок-схема спектрометра ЯМР.
3. Времена спин-решеточной и спин-спиновой релаксации.
4. Химический сдвиг и его измерение.
5. Спин-спиновые взаимодействия.
6. Уравнения Блоха.
7. Обменные процессы.
8. Методика записи и расшифровка спектров 1Н ЯМР.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Резвухин А.И. Спектроскопия ядерного магнитного резонанса высокого разрешения. Новосибирск: Изд. НГУ, 1979.
2. Сильверстейн Р. и др. Спектрометрическая идентификация органических соединений. М.: Мир, 1977.
3. Керрингтон А., Мак-Лечлан Э. Магнитный резонанс и его применение в химии. М.: Мир,1970.
4. Маров И.Н., Костромина Н.А. ЭПР и ЯМР в химии координационных соединений. М.: Наука, 1979.
5. Воронов В.К., Сагдеев Р.З. Основы магнитного резонанса. Иркутск: Вост.-Сиб. кв. изд-во, 1995.
6. Фаррар Т., Беккер Э. Импульсная и фурье-спектроскопия ЯМР. М.8 Мир, 1973.
7. Дероум Э. Современные методы ЯМР для химических исследований. М.: Мир, 1992.
8. R.K. Harris. Nuclear Magnetic Resonance Spectroscopy. A Physicochemical View, Pitman, London,1983.
9. M. Hesse, H. Meier, B. Zeeh. Spectroscopic Methods in Organic Chemistry, Thieme, Stuttgart, 2008.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.