Пероксид водорода в присутствии переходного металла образует гидроксильный радикал, наиболее активно модифицирующий клеточные биополимеры (схемы 25 и 26):
Fe2+ или Cu+ + H2O2 + H+ → Fe3+ или Cu2+ + •OH + H2O(25),
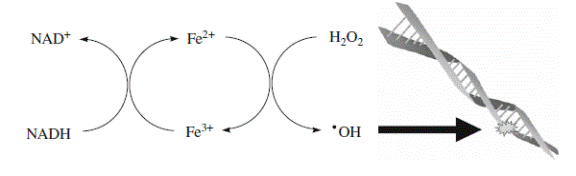 (26).
(26).
Предполагают, что биофлавоноиды, являясь полифенолами, способны связывать переходные металлы (железо, медь), тем самым уменьшая образование гидроксильных радикалов (схема 27) и защищая организм от их действия.
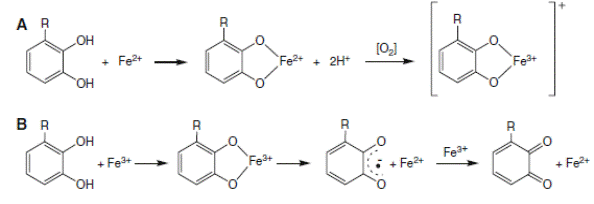 (27).
(27).
На схеме 28 представлены комплексы железа с рутинном и кверцетином.
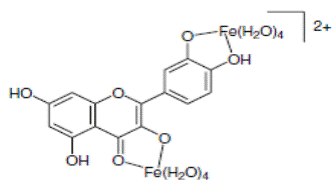
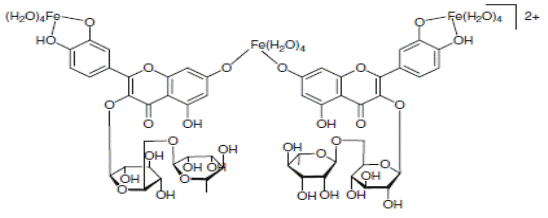 (28).
(28).
6.1.3. Азот. В окружающей среде элемент азот встречается в виде молекулярного азота, неорганических (нитриты, нитраты, аммонийные соли и т. д.) и органических (мочевина, амины, аминокислоты, нуклеотиды) соединений. Значение органических соединений азота для организмов велико. Стоит только упомянуть, что ни один живой организм не способен существовать без белков и нуклеиновых кислот и без их мономеров − аминокислот и нуклеотидов. Так для синтеза аминокислот необходим аммиак. Большинство организмов получают его из пищи путем восстановления нитратов или нитритов или гидролиза потребляемых белков.
Атомы в молекуле азота связаны прочной тройной ковалентной связью, из-за чего он практически не вступает в реакции окисления-восстановления в нормальных условиях без применения катализаторов и не может использоваться растениями и животными. Лишь небольшая часть организмов способна синтезировать аммиак из молекулярного азота.
6.1.3.1. Азотфиксация. Для получения азотных удобрений, необходимых для развития культивируемых растений, человечество затрачивает ежегодно огромные деньги, при этом в больших количествах образуются токсические отходы, загрязняющие окружающую среду. Микроорганизмы в течение миллионов лет незаметно и чисто восстанавливают молекулярный азот до иона аммония, затрачивая на это энергию гидролиза АТР и восстановительные эквиваленты NADH и используя серию ферментов (ферредоксин, гидрогеназа), важнейшим из которых является нитрогеназа (К.Ф. 1.18.6.1). Этот процесс называется азотфиксацией и осуществляется азотфиксирующими микроорганизмами, в наземных экосистемах обитающих в основном в почве (это представители трех семейств: Azotobacter, Clostridium, Rhizobium). Некоторые из них, например клубеньковые бактерии (сем. Rhizobiaceae), существуют в симбиозе с бобовыми растениями. Азотфиксаторы живут также в кишечнике многих животных (жвачные, грызуны, термиты) и человека (род Escherichia).
Восстановление азота состоит из трех стадий, на каждой из которых происходит присоединение к восстанавливаемой молекуле пары электронов и двух протонов (схема 29):
N2 + 2 e + 2 H+ → NH=NH + 2 e + 2 H+ → NH2−NH2 + 2 e +
+ 2 H+ → 2 NH3 (29).
Общее уравнение процесса азотфиксации можно записать в следующем виде (схема 30):
N2 + 8 e + 8 H+ + 16 MgATP → 2 NH3 + 16 MgADP +
+ 16 Pi + H2 (30).
Нитрогеназа представляет собой комплекс из двух ферментов: собственно нитрогеназа, содержащая Mo-Fe-белковый кофактор и называемая также динитрогеназой, и редуктаза нитрогеназы (Fe-белок). Оба фермента сохраняют свои каталитические свойства только в комплексе, при разделении они инактивируются. Ферментативной активностью обладают также «гибриды», например, из Mo-Fe-белкового кофактора азотобактерии с Fe-белком клубеньковых бактерий.
Mo-Fe-Белковый кофактор (молекулярной массой 200−250 kDa) состоит из четырех субъединиц двух типов (α и β), содержит 2 атома Мо (в виде FeMo-кофактора), 28−34 атома негемового железа и 18−24 атома сульфидной серы. Fe-Белок (молекулярной массой 50−60 kDa) состоит из двух одинаковых субъединиц. Для своего функционирования нитрогеназа нуждается в непрерывном притоке как энергии (в форме АТР), так и электронов. Это обеспечивается благодаря дыханию и брожению, происходящим в микроорганизмах, или в результате фотосинтеза (в цианобактериях). АТР специфически связывается с Fe-белком (две молекулы на димер), и образовавшийся комплекс переносит электроны от ферредоксина или флаводоксина с помощью железо-серного кластера [4Fe−4S] (одного на димерную молекулу Fe-белка) (схема 31) к Mo-Fe-белковому кофактору.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.