2 О2− + 2 Н+ → Н2О2 + О2 (10).
Изоферменты супероксиддисмутазы обнаружены в цитоплазме, в митохондриях клеток, а также во внеклеточном пространстве. Это индуцируемый фермент, количество которого увеличивается при активации перекисного окисления.
Превращение супероксида, катализируемое супероксиддисмутазой, можно разбить на две реакции:
M(n+1)+ − СОД + O2− → Mn+ − СОД + O2,
Mn+ − СОД + O2− + 2H+ → M(n+1)+ − СОД + H2O2,
где M представляет собой переходный металл, а именно: Cu (n=1) ; Mn (n=2) ; Fe (n=2) ; Ni (n=2). В данной реакции окислительное состояние катиона металла изменяется между n и n+1.
Существует несколько форм супероксиддисмутазы в зависимости от типа переходного металла, играющего роль кофактора активного центра фермента: Cu, Zn-СОД, в которой медь выступает кофактором активного центра, а цинк стабилизирует конформацию, Mn-СОД (с марганцем в активном центре), а также менее распространённые Fe-СОД (с железом) и Ni-СОД (с никелем).
Cu, Zn-СОД − самая распространённая супероксиддисмутаза, обнаруженная в цитозоле практически всех эукариотических клеток, является гомодимером молекулярной массой 32,5 kDа. Cтруктура гомодимера стабилизирована образованием гидрофобных и элект-ростатических связей. Медь и цинк связаны с белковой частью молекулы через гистидиновые остатки.
Митохондрии эукариотических клеток и многие бактерии содержат Mn-СОД, представляющую собой гомотетрамер, содержащий по одному иону марганца на каждую субъединицу, например митохондриальная СОД человека (К.Ф. 1.15.1.1) молекулярной массой 86−88 kDа . Марганец в этом ферменте координирован с белком через три гистидина и аспартат и с водой либо гидроксильным лигандом в зависимости от окислительного состояния марганца (Mn2+ или Mn3+) (рис. 6.1).
E. coli и многие другие бактерии содержат формы фермента с железом в активном центре (Fe-СОД). У бактерий Mn-СОД и Fe-СОД представлены как гомодимерными, так и гомотетрамерными формами.
СОД является одним из наиболее термостабильных глобулярных белков: выдерживает нагревание до 80 оС, сохраняет свою активность даже в 8 М растворе мочевины.
Супероксиддисмутаза, поддерживая стационарную концентрацию супероксидных радикалов на определенном уровне, защищает тем самым клеточные структуры от повреждающего действия как самих радикалов О2•-, так и от появления гидроксильных радикалов, которые могут образовываться из супероксидного радикала.
СОД играет важную роль в процессе старения организмов и при некоторых заболеваниях, таких как гемолитическая анемия, ишемия, ряд нейрологических заболеваний. Существенная роль отводится супероксидным радикалам в развитии воспалительных процессов.
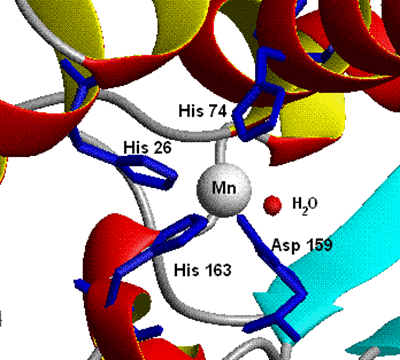
Рис. 6.1. Структура активного центра митохондриальной Mn-супероксиддисмутазы человека (согласно )
Успешное лечение с помощью СОД воспалительных процессов, например при артритах, позволяет рассматривать этот фермент как альтернативу кортикостероидам.
Каталаза
Образовавшийся пероксид водорода подвергается превращениям под действием каталазы (схема 11):
2 Н2О2 → 2 Н2О + О2 (11).
Каталаза (К.Ф. 1.11.1.6) локализована в основном в пероксисомах, где образуются наибольшие количества пероксида водорода, и в лейкоцитах для защиты клеток от последствий «респираторного взрыва» (см. п. 6.1.2.2).
Каталаза в зависимости от структуры относится к одному из трех семейств. Семейство 1 каталаз − это тетрамерные белки, состоящие из больших или малых субъединиц, содержащих гем. Гем включается в фермент во время его сборки в пероксисомах из мономеров, которые гем не содержат. Семейство 2 − это бифункциональные ферменты, проявляющие и каталазную, и пероксидазную активности и являющиеся гем-содержащими асимметричными димерами. Семейство 3 − гексамерные белки, содержащие по два иона марганца на мономер (рис. 6.2).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.