Рис. 6.9. Пространственная структура активного центра пируваткиназы из дрожжей. Ион К+ изображен желтым шариком, ион Mn2+ − зеленым, фосфатная группа фосфоенолпирувата (РЕР) − красно-лиловым. Ионы К+ и Mn2+ оптимизируют связывание субстрата и облегчают перенос фосфатной группы от РЕР на ADP (согласно Page M. J., Di Cera E. Role of Na+ and K+ in enzyme function // Physiol. Rev. 2006. Vol. 86. P. 1049–1092.)
таким образом, что каталитический Asp189 ориентируется правильным образом относительно Arg, пептидная связь которого должна гидролизоваться (рис. 6.10).
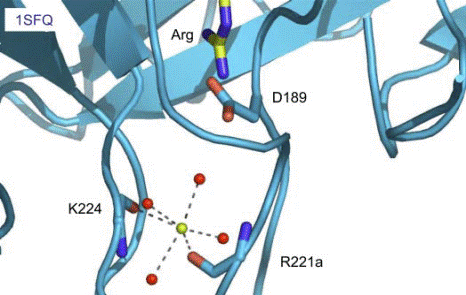
Рис. 6.10. Пространственная структура аллостерического сайта, связывающего ион Na+ в Na+-активируемом ферменте II типа − тромбине (согласно Page M. J., Di Cera E. Role of Na+ and K+ in enzyme function // Physiol. Rev. 2006. Vol.86. P. 1049–1092.)
Многие процессы, в которых принимают участие моновалентные ионы, основаны на том, что ион Na+ входит через ионные каналы в клетку в обмен на выход из нее иона К+. Для возвращения клетки в исходное состояние необходимо вывести натрий наружу и ввести внутрь клетки калий. Этот процесс катализирует Na+, К+-АТРаза (натрий, калий-ионный насос).
Na+,K+-АТРаза представляет собой гетеродимерный интегральный белок плазматических мембран, состоящий из большой α- и меньшей β-субъединиц (рис.6.11) и осуществляющий АТР-зависи- мый трансмембранный перенос Na+ и К+ в клетках эукариот против градиента их концентраций.
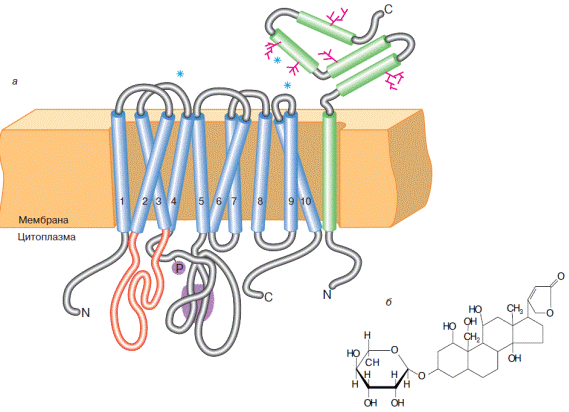
Рис. 6.11. Схема расположения Na+,K+-АТРазы в клеточной мембране (а) и структура ее специфического ингибитора − уабаина (б). Мембранная часть α-субъединицы состоит из 10 α-спиралей, пронизывающих мембрану (изображены голубым цветом) и образующих несколько петель. Петля между второй и третьей α-спиралями (красная) участвует в образовании центра связывания ионов. На петле между четвертой и пятой α-спиралями локализован центра связывания АТР и участор фосфорилирования (Р) (лиловый). β –субъединица на С-конце гликозилирована. Звездочками помечены сайты связывания уабаина (согласно Болдырев А.А. Na/K-АТФаза − свойства и биологическая роль // Соросовский образовательный журнал. 1998. № 4 .С. 2−9.)
α-Субъединица способна выполнять функцию ионного насоса и в отсутствие β-субъединицы, роль которой, предположительно, заключается в обеспечении правильной ориентации большей субъединицы в клеточной мембране.
На рис. 6.12. приведена схема реакции переноса моновалентных ионов через клеточную мембрану, осуществляемую Na+,K+-АТРа- зой. Сначала переносчик присоединяет с внутренней стороны мембраны три иона Na+. Эти ионы изменяют конформацию активного центра АТРазы. После такой активации АТРаза способна гидролизовать одну молекулу АТР, причем фосфат-ион фиксируется на поверхности переносчика с внутренней стороны мембраны. Выделившаяся энергия расходуется на изменение конформации АТРазы, после чего три иона Na+ оказываются на внешней стороне мембраны. Здесь ионы Na+ отщепляются, а переносчик связывает два иона К+. Затем конформация переносчика изменяется на первоначальную, и ионы К+ оказываются на внутренней стороне мембраны. Здесь ионы К+ отщепляются, и Na+,K+-АТРаза вновь готова к работе.
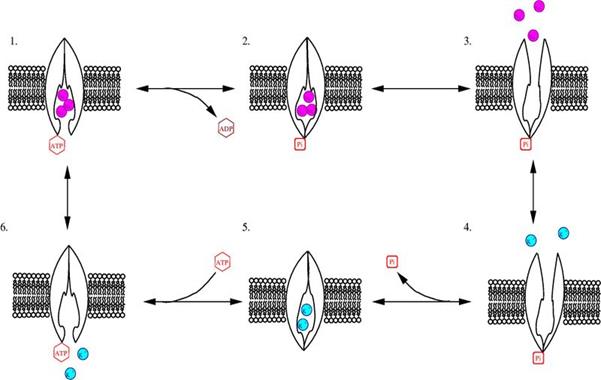
Рис. 6.12. Схема переноса ионов натрия и калия через клеточную мембрану, катализируемого Na+,K+-АТРазой
6.1.7. Щелочноземельные металлы: магний и кальций.
6.1.7.1. Магний. Магний относится к группе макроэлементов. Физиологически активной формой этого элемента выступает катион Mg2+, который занимает по значимости для клетки второе место после калия и четвертое место для всего организма, играя важную физиологическую роль в его функционировании. Половина количества магния, содержащегося в организме, приходится на мягкие ткани, вторая половина − в костях, откуда магний извлекается в случае необходимости. 1 % от общего количества магния содержится во внеклеточных жидкостях.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.