Рис. 6.3. Схема реакции, катализируемой глутатионпероксидазой. Ионизованная форма остатка селеноцистеина в активном центре фермента стабилизируется остатками Trp148 и Gln70 (схема справа). Под действием пероксидов происходит окисление селеноцистеина до селенильной кислоты (схема слева), которая восстанавливается обратно в селеноцистеин двумя молекулами GSH с образованием промежуточного соединения селенилсульфида (EnzSeSG) (согласно Mugesh G., du Mont W.-W. Structure−activity correlation between natural glutathione peroxidase (GPx) and mimics: A biomimetic concept for the design and synthesis of more efficient GPx mimics // Chem. Eur. J. 2001. Vol. 7. P. 1365−1370.)
Таким образом, недостаток селена в организме приводит к увеличению активных форм кислорода в клетках, что в свою очередь проявляется в ослаблении иммунной системы организма и возникновению заболеваний, связанных с многочисленными изменениями в структуре и функциях биополимеров (белков, нуклеиновых кислот и липидов).
Восстановление дисульфидной формы глутатиона (G-S−S-G) происходит в организме с помощью флавопротеина глутатионредуктазы, представляющей собой гомодимер и состоящей из нескольких доменов: FAD- и NADPH-связывающих, домена для взаимодействия мономеров при образовании димера. FAD-связываю- щий домен располагается на N-конце молекулы фермента, как видно из рис. 6.4. Восстановление димерной формы глутатиона происходит за счет передачи электронов от NADPH (NADH) через FADH2 к G-S−S-G (схема 12).
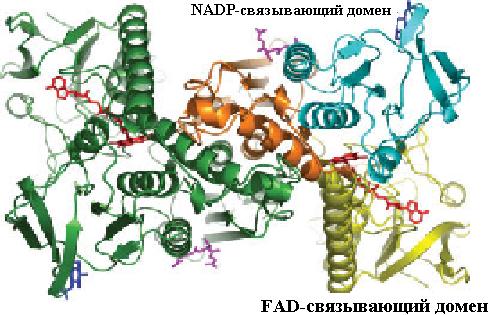
Рис. 6.4. Пространственная структура гомодимерных белков, входящих в семейство глутатионредуктазы. Домены фермента выделены цветом: FAD-связывающий − желтым, NADP-связывающий − бирюзовым, домен, связывающий мономеры друг с другом, − оранжевым (согласно Yu J., Zhou C.-Z. Crystal structure of glutathione reductase Glr1 from the yeast Saccharomycescerevisiae // Proteins. 2007. Vol. 68. P. 972–979.)
Витамин Е
Один из наиболее распространенных природных антиоксидантов витамин Е (структура соединений, входящих в семейство витамина Е, приведена на схеме 19), являясь липофильной молекулой, взаимодействует с активными формами кислорода непосредственно в гидрофобном слое мембран, предотвращая развитие цепи ПОЛ.
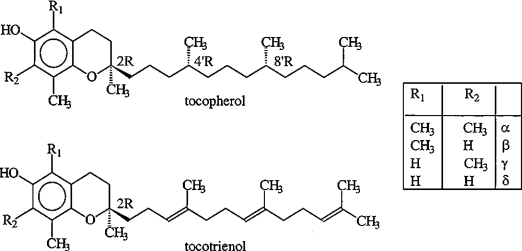 (19).
(19).
Он восстанавливает свободный радикал пероксида липида (LOO•) до гидропероксида LOOH, тем самым останавливая ПОЛ (схема 20).
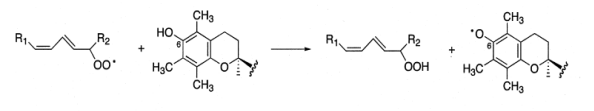 (20).
(20).
Витамин С
Аскорбиновая кислота (витамин С) (структура и превращения аскорбиновой кислоты в результате окислительно-восстановитель- ной реакции приведены на схеме 21) может принимать участие в ингибировании реакций ПОЛ по двум направлениям:
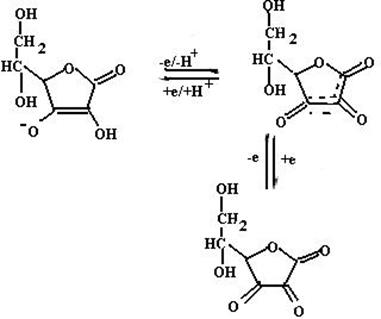 (21).
(21).
1) она восстанавливает окисленную форму витамина Е, тем самым поддерживая необходимую его концентрацию в мембранах клеток;
2) витамин С восстанавливает водорастворимые активные формы кислорода (супероксидный радикал, пероксид водорода и гидроксильный радикал), инактивируя их.
Витамин А
Витамин А (ретинол) и его предшественники − каротиноиды (α-, β-каротины), структура которых приведена на схеме 22, обладая антиоксидантным действием, также активно ингибируют развитие ПОЛ.
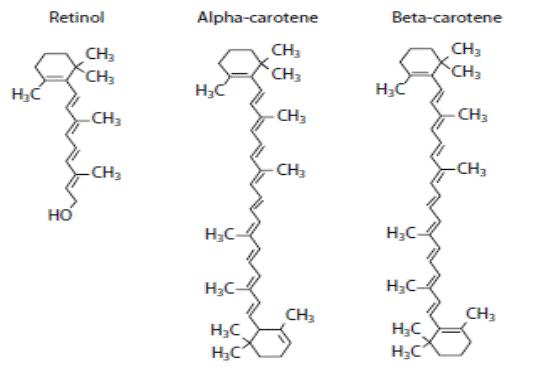 (22).
(22).
Биофлавоноиды
К системам защиты организма от действия активных форм кислорода относят также биофлавоноиды. Эти соединения являются полифенолами. Среди них различают флавоны, флавонолы, флаваноны, антоцианы, катехины (рис. 6.5), обнаруженные в больших количествах в составе растений, например, в чайном листе. К наиболее известным и используемым среди биофлавоноидов относят кверцетин и рутин (схема 23):
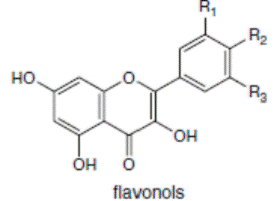
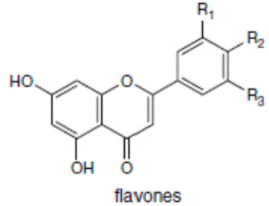
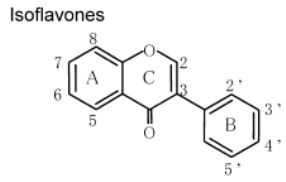
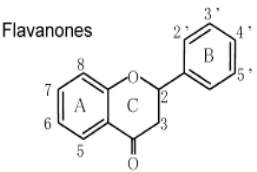
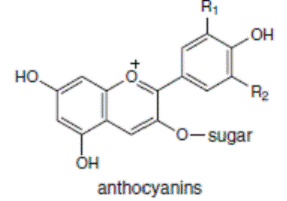
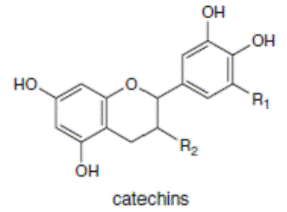
Рис. 6.5. Структура биофлавоноидов, среди которых различают флавонолы, флавоны, изофлавоны, флаваноны, антоцианы, катехины
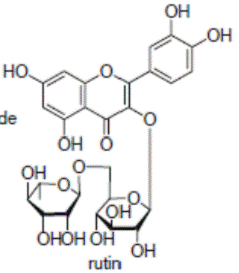
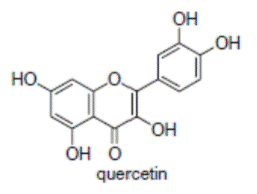 (23).
(23).
Механизм защитного действия биофлавоноидов еще недостаточно выяснен. Известно, что переходные металлы (железо) в организме реагируют с супероксидным радикалом с образованием пероксида водорода (схема 24):
[2Fe2+2Fe3+−4S] + O2•− + 2H+ → [Fe2+3Fe3+−4S] + H2O2 (24).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.