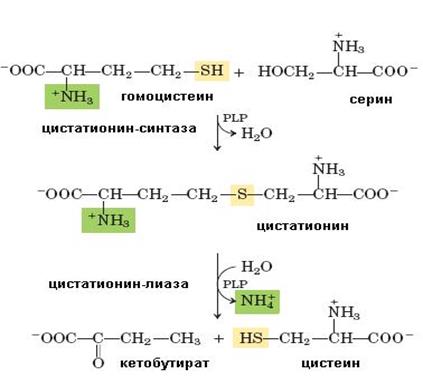
Цистеин в организме образуется из метионина (первичный источник атома серы) и серина (источник углеродного скелета). Сначала метионин превращается в гомоцистеин с образованием на промежуточных стадиях S-аденозилметионина, S-аденозилгомоцисте-ина, гомоцистеин, взаимодействуя с серином, дает цистатионин, расщепляющийся далее на цистеин и α-кетобутират (схема 64).
 (64)
(64)
(продолжение рис. 6.38 на следующей странице)
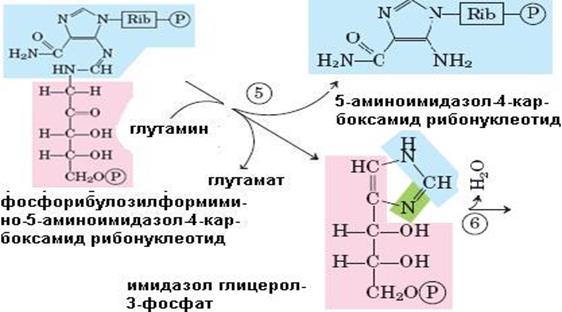
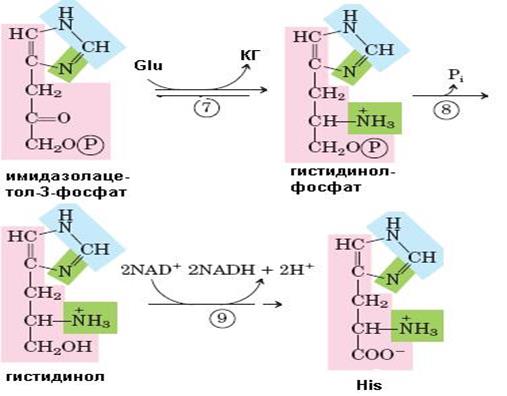
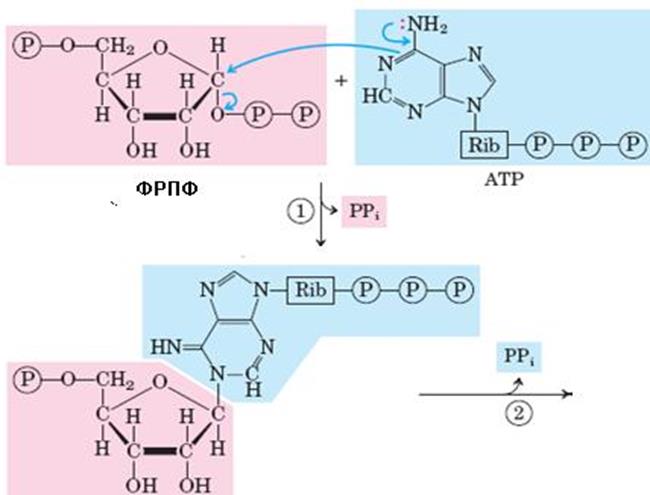
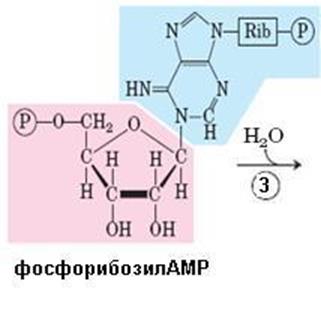
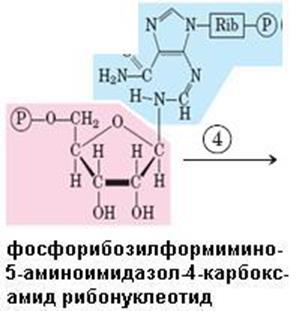
Рис. 6.38. Синтез гистидина. Атомы гистидина, происходящие из 5-фосфорибозил-1-пирофосфата (ФРПФ) и АТР изображены розовым и голубым цветом, атомы азота Gln или Glu – зеленым. Ферменты, участвующие в синтезе His: 1 – АТР-фосфорибозил-трансфераза; 2 – пирофосфогидролаза; 3 – фосфорибозил-АМР циклогидролаза; 4 – фосфорибозилформимино-5-аминоимидазол-4-карбоксамид рибонуклеотидизомераза; 5 – глутаминамдотрансфераза; 6 – имидазолглицерол-3-фосфатдегидратаза; 7 – гистидинолфосфат аминотрансфераза; 8 – гистидинолфосфат фосфатаза; 9 – гистидинолдегидрогеназа; КГ – α-кетоглутарат
Цистатионин-β-синтаза и цистатион-γ-лиаза, ферменты, катализирующие синтез и распад цистатионина, содержат в качестве кофермента пиридоксальфосфат (PLP).
Цистеин используется для синтеза белков, в образовании третичной структуры которых играет главную роль, в синтезе трипептида-антиоксиданта глутатиона, таурина (2-аминоэтилсульфоната), важной составной части желчных кислот, кофермента А и т. д.
Биосинтез гистидина, второй условно заменимой аминокислоты, начинается с 5-фосфорибозил-1-пирофосфата (ФРПФ) с использованием фрагмента аденинового кольца АТР и атома азота глутамина (рис. 6.38).Гистидин, содержащий пять углеродных атомов, катаболизируется до α-кетоглутарата. Промежуточными соединениями этого превращения являются урокановая кислота, 4-имидазолон-5-пропионат, N-формиминоглутамат и глутаминовая кислота (рис. 6.39).
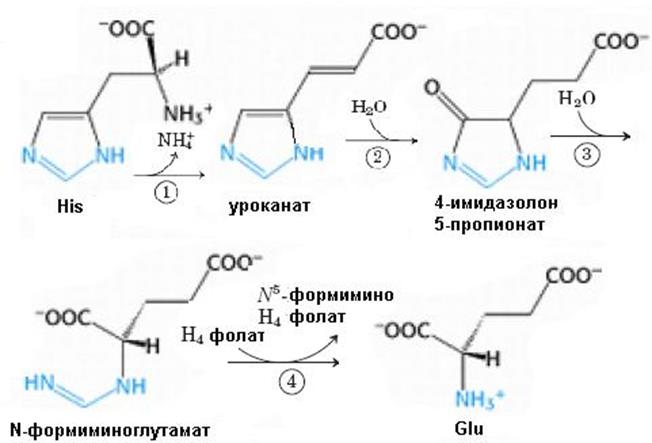
Рис. 6.39. Распад гистидина. Ферменты, катализирующие отдельные стадии этого превращения: 1 – гистидинаммиаклиаза (гистидиназа); 2 – уроканатгидратаза; 3 – имидазолонпропионаза; 4 – глутаматформиминотрансфераза
При декарбоксилировании гистидина в тучных клетках соединительной ткани образуется гистамин, играющий роль нейромедиатора. Это соединение также участвует в развитии иммунных, аллергических и воспалительных реакций, вызывая покраснение кожи и отечность тканей. Гистамин появляется в кровотоке при повреждениях тканей в результате ожога, удара, выполняет функцию пищеварительного гормона, стимулируя секрецию желудочного сока (см. Часть 5. Биохимия процессов пищеварения, п. 5.1.1, с. 96), повышает проницаемость капилляров, сокращает гладкую мускулатуру легких, вызывая удушье. Это соединение ответственно за болевой синдром.
Тирозин образуется в результате реакции гидроксилирования фенилаланина, катализируемой монооксигеназой − фенилаланингидроксилазой (рис. 6.40). Коферментом в этой реакции служит 5,6,7,8-тетрагидробиоптерин, атом уходит в молекулу воды, второй внедряется в виде гидроксильной группы в n-положение фенилаланина. Окисленная форма 7,8-дигидро-биоптерин восстанавливается с помощью NADH и дигидробиоптеринредуктазы.
В случае пониженной активности фермента фенилаланингидроксилазы происходит переаминирование фенилаланина с образованием фенилпирувата и продуктов его дальнейшего превращения: фениллактата, фенилацетата, фенилацетилглутамина. Все названные соединения, токсичные для мозговых клеток, выделяются с мочой. Это заболевание называется фенилкетонурией. Чаще всего это наследственное заболевание, обусловленное мутациями в гене фенилаланингидроксилазы, приводящее к снижению активности фермента или полной его инактивации. Большие концентрации фенилаланина препятствуют синтезу из тирозина нейромедиаторов: дофамина, норадреналина.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.