Реакция, катализируемая семействами 1 и 2 каталаз, состоит из двух стадий: сначала один атом кислорода из пероксида водорода включается в состав молекулы воды, а второй восстанавливается гемом с образованием оксоферрильного порфирин π-радикального комплекса (compound I) (один электрон передается ионом железа, второй происходит из порфиринового кольца) (схема 12). Во время второй стадии реакции оксоферрильное производное взаимодействует со второй молекулой пероксида водорода с образованием молекул воды, кислорода и восстановлением исходной формы фермента (схема 13).
Enz (Por-Fe3+) + H2O2 → Cpd I (Por+.-Fe4+ = O) + H2O (12),
Cpd I (Por+.-Fe4+= O) + H2O2 → Enz (Por-Fe3+) + H2O + O2 (13),
где Enz − каталаза, Por− порфирин, Cpd I− промежуточное производное I (compound I).
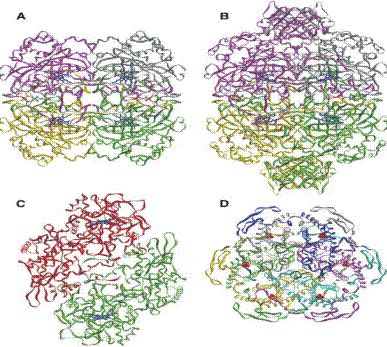
Рис. 6.2. Пространственная структура каталазы: А − тетрамер, состоящий из малых субъединиц (Pseudomonas syringae); В − тетрамер, в состав которого входят большие субъединицы (E. Coli); С − димерная структура бифункционального фермента каталазы-пероксидазы (Burkholderia pseudomallei); D − гексамер Мn2-содержащей каталазы (Lactobacillus plantarum). Гем в структурах А и В изображен синим цветом, ионы Мn в структуре D − красным (согласно Chelikania P., Fitab I., Loewena P.C. Diversity of structures and properties among catalases // Cell. Mol. Life Sci. 2004. Vol. 61. P. 192–208)
В случае пероксидазной реакции, катализируемой ферментами семейства 2, необходим органический донор электронов для протекания второй стадии (8):
Cpd I (Por+.-Fe4+= O) + 2AH2 → Enz (Por-Fe3+) + 2AH• + H2O (14),
где AH2 является органическим соединением − донором электронов.
Особенностью этой группы ферментов является наличие в структуре ковалентного аддукта Мet-Tyr-Trp, в случае его отсутствия протекает только пероксидазная реакция.
Каталазы, относящиеся к семейству 3, катализируют реакции превращения пероксида водорода, где роль восстановителя выполняет комплекс из двух катионов марганца (схемы 15 и 16):
H2O2 + Mn2+-Mn2+ (2H+) → Mn3+-Mn3+ + 2 H2O (15),
H2O2 + Mn3+-Mn3+ → Mn2+-Mn2+ (2H+) + O2 (16),
т. е. центр, содержащий два иона марганца, ведет себя аналогично гему в каталазах семейств 1 и 2.
Глутатионпероксидаза
Огромное значение для инактивации активных форм кислорода имеет глутатионпероксидаза (К.Ф. 1.11.1.9), катализирующая восстановление пероксида водорода и липидных гидропероксидов с помощью глутатиона − γ-глутамилцистеинилглицина (GSH). Сульфгидрильная группа GSH окисляется до дисульфидной формы, отдавая электроны пероксиду водорода или гидропероксиду липида (схема 17):
2 Н2О2 + GSH → 2 Н2О + G-S−S-G (17).
Окисленный глутатион восстанавливается под действием глутатионредуктазы (К.Ф. 1.6.4.2) (схема 18):
G-S−S-G + NADPH + H+ → 2 GSH + NADP+ (18).
В организме животных в зависимости от органа и ткани обнаружено несколько форм глутатионпероксидаз. Глутатионпероксидаза чаще всего представляет собой гомотетрамер. В активном центре большинства из них присутствует остаток селеноцистеина, необходимый для протекания ферментативной реакции.
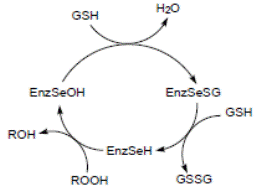
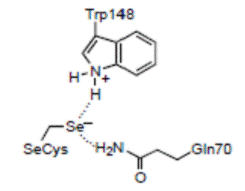
На рис. 6.3 приведена схема реакции, катализируемой глутатионпероксидазой. На первой стадии реакции остаток селеноцистеина, ионизованная форма которого стабилизируется остатками Trp148 и Gln70 (нумерация аминокислотных остатков приведена для фермента из бычьих эритроцитов, но оба остатка, являясь консервативными, присутствуют практически во всех глутатионпероксидазах), окисляется под действием пероксидов до селенильной кислоты RSeOH. Следующие две стадии реакции заключаются в регенерации селеноцистеина с помощью двух молекул глутатиона с образованием промежуточного продукта селененилсульфида (EnzSeSG).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.