Ионы Mn2+ способны замещать ионы Mg2+ в ферментативных реакциях. Но из-за разных размеров этих ионов, например, в фосфотрансферазных реакциях (ион Mg2+ координирует α- и β-фосфатные остатки dNTP (NTP), а Mn2+ способен взаимодействовать со всеми тремя остатками) наблюдается много ошибок в считывании матриц ДНК или РНК ДНК- и РНК-полимеразами.
Марганец является токсичным соединением для большинства организмов. Так, попадая в митохондрии, он нарушает функционирование дыхательной цепи, ингибируя окислительное фосфорилирование, что приводит к недостаточному энергетическому потенциалу клеток организма. В нейронах и астроцитах марганец отрицательно воздействует на выделение многих нейротрансмиттеров: глутамина, ГАМК и т.д. Отложение марганца в нервной ткани головного мозга является одним из факторов развития болезни Паркинсона. При болезни Альцгеймера у пациентов также определяется повышенное содержание марганца в головном мозге.
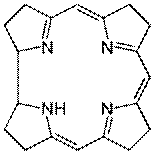
6.1.8.4. Кобальт. Важность этого переходного металла в жизнедеятельности организмов определяется тем, что он является составной частью витамина В12, кофермента кобаламин-зависимых ферментов. Витамин В12 содержит корриновое кольцо, состоящее из четырёх пиррольных гетероциклов, соединённых тремя метиленовыми мостиками и одной углерод-углеродной связью. От порфирина, входящего в состав гема, коррин отличает отсутствие метиленового мостика между парой пиррольных колец (схема 49).
 (49)
(49)
У коррина в сравнении с порфирином, во-первых, нарушена система сопряженных двойных связей, во-вторых, структура не такая плоская, как структура порфирина. В структуре витамина В12 ион кобальта Со3+ располагается в центре корринового ядра, образуя координационные связи с атомами азота пиррольных гетероциклов, с находящимися по разные стороны плоскости корринового кольца диметилбензимидазолом и цианид-ионом (гидрокси-анионом, метильной группой или 5’-дезоксиаденозильным остатком) (схема 50).
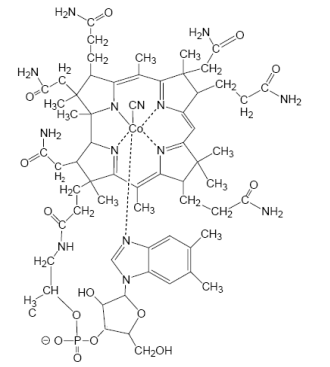 (50)
(50)
Особенность витамина В12 заключается в том, что он содержит σ-связь между кобальтом и атомом углерода, которая не встречается в других природных металлоорганических соединениях. Распад этой связи приводит к образованию радикала, который является важной составной частью механизма действия кобаламин-зависимых ферментов.
Всасывание витамина В12 происходит в желудке в комплексе с гликопротеином – внутренним фактором Касла, который секретируется обкладочными клетками слизистой оболочки желудка. После поступления в клетки слизистой (энтероциты) в дистальном отделе повздошной кишки комплекс разрушается, фактор Касла или подвергается протеолизу, или секретируется в просвет кишечника, а В12 связывается с транскобаламином. Нарушение всасывания витамина В12 наблюдаются при пернициозной анемии, когда имеет место генетический дефект синтеза фактора Касла, при резекции желудка, заражении гельминтами.
Транспорт витамина В12 в крови осуществляют особые белки – транскобаламины. Они же выполняют функцию его депонирования.
В печени происходит превращение витамина В12 в гидроксикобаламин, далее в митохондриях Со3+ в составе витамина восстанавливается в Со+, после чего дезоксиаденозилтрансфераза замещает ОН-ион на остаток дезоксиаденозила, превращая витамин В12 в кофермент 5’-аденозилкобаламин. Под действием S-аденозилметио-нин-В12-метилтрансферазы образуется другой кофермент − метилкобаламин. Оба кофермента представляют собой биологически активные формы витамина В12 в организме человека. Они входят в состав ферментов, обнаруженных у многих животных – метилмалонилСоА-мутазы (ММСМ), катализирующей превращение метималонилСоА в сукцинилСоА, и тетрагидроптероилглутамат-метилтрансферазы (ТГМТ), участвующей в синтезе метионина из гомоцистеина.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.