При взаимодействии определенных гормонов со своими рецепторами в клеточной мембране может происходить открытие специальных ионных каналов, по которым внеклеточный кальций поступает внутрь клетки. Открытие каналов эндо/саркоплазматического ретикулума происходит под действием вторичных посредников фосфоинозитидов. Строение и механизмы действия ионных каналов, Na+/Ca2+-обменников и Са2+-АТРазы (кальциевого насоса) будут подробно рассмотрены в Части 7. Молекулярные механизмы межклеточной химической сигнализации.
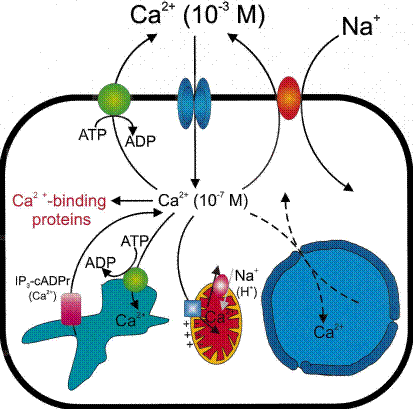
Рис. 6.13. Схема поступления иона кальция в клетку с помощью кальциевых ионных каналов в клеточной мембране или Na+/Ca2+-обменников в мембранах сарко/эндоплазматического ретикулума и митохондрий. Уменьшение концентрации ионов кальция после проведения сигнала в клетку происходит под действием Са2+-АТРазы (кальциевого насоса)
После поступления иона кальция в клетку он связывается с определенными белками. Эти белки, изменив свою конформацию, способны влиять на многочисленные и разнообразные процессы: транспорт кальция, регуляция клеточного цикла и активности определенных ферментов, состояние цитоскелета. Так например кальмодулин, один из наиболее распространенных регуляторных Са2+-связыва- ющих белков, узнает, может связать и оказать регуляторное воздействие на более чем 350 разных белков. Часто он является одной из субъединиц сложных белков и участвует в регуляции активности различных киназ, синтетаз и других ферментов. Кальмодулин, связанный с ионом кальция, оказывает также регуляторное воздействие на функционирование структурных элементов клетки: актин-миозиновый комплекс, микрофибриллы, ответственные за клеточную подвижность, изменение формы клетки, митоз, эндоцитоз и т. д. (см. Часть 2. Биохимия движения. Регуляция сокращения и расслабления мышц). Участие иона кальция в процессе свертывания крови подробно рассмотрено в Части 1. Биохимия дыхания. Свертывающая система крови.
В ответ на стимул происходит мобилизация клеточных механизмов для удаления кальция, после чего клетка переходит в состояние покоя, таким образом повышение концентрации иона кальция было кратковременным.
Са2+-связывающие белки должны иметь большое сродство к этому иону, чтобы 1) связывать его уже при малых концентрациях; 2) различать похожие ионы кальция и магния, концентрация которого в клетке достаточно высока (10-3−10-2 М).
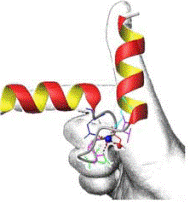
Ион кальция сильно гидратирован и удерживает вокруг себя 6−8 молекул воды. Одномоментного замещения такого количества воды невозможно, поэтому структура, связывающая ион кальция должна быть достаточно гибкой, чтобы взаимодействовать как с полностью гидратированным ионом, так и с ионом, частично потерявшим молекулы воды. Гибкость белкового окружения нужна также и для экранирования иона кальция от воды. Гибкость обеспечивается за счет того, что большинство Са2+-связывающих белков (тропонин С, миозин, кальмодулин, кальпаин, парвальбумин, кальбиндин D и др.) содержат пространственную структуру, состоящую из мотива спираль-петля-спираль. Петля состоит из 11−14 аминокислотных остатков, α-спиральные участки по бокам − из 12−14 аминокислотных остатков, при этом они располагаются почти перпендикулярно друг другу. Впервые эта структура была обнаружена в белке из мышц рыб парвальбумине и получила название EF-hand. Са2+-связывающие центры сравнивают с правой рукой (hand): отставленные большой и указательный пальцы соответствуют двум α-спиральным участкам мотива, остальные сложенные пальцы изображают Са2+-связываю- щую петлю (рис. 6.14). В структуре парвальбумина на рентгенограммах четко прослеживалось расположение двух α-спиральных участков, обозначенных Е- и F.
. 
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.