где цветом изображены разные классы доменов, а красные, зеленые и синие кружочки − ионы меди I, II и III типа (45);
а б в
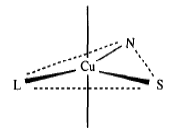
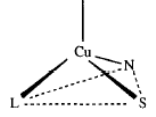
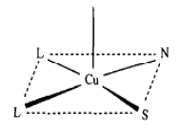
место связывания место связывания
иона меди I типа иона меди II типа (46)
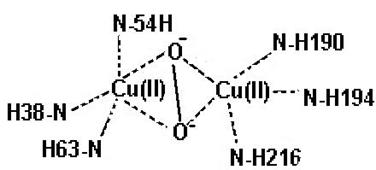
2) место связывания иона меди II типа (схема 46, в), в котором в координационной сфере, содержащей 3−4 лиганда, присутствуют остатки гистидина (несколько), глутамата, глутамина, метионина и тирозина, остатков цистеина нет, имеет слегка искаженную плоскостную конфигурацию. Чаще всего это мононуклеарные сайты. Одно из положений координационной сферы иона меди занимает
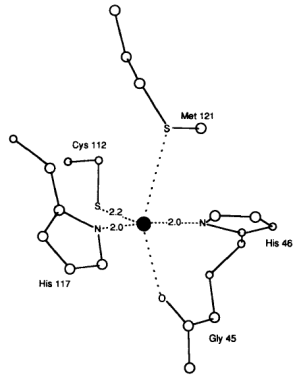
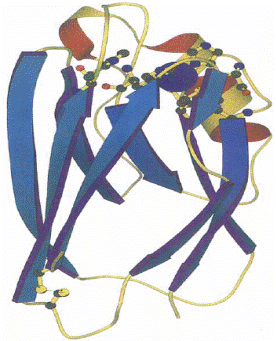
Рис. 6.21. Пространственная структура азурина (справа) и место связывания иона меди I типа в этом белке (слева) (согласно Malmstrom B.G. Rack-induced bonding in blue-copper proteins // Eur. J. Biochem. 1994. Vol. 223. P. 711−718.)
непосредственно субстрат: если это молекула кислорода, то центр связывания иона меди II типа может функционировать как оксидаза, восстанавливая кислород с образованием воды или пероксида водорода (аминооксидаза), или монооксигеназа (дофамингидроксилаза), включая один атом кислорода в продукт реакции, второй в молекулу воды, или диоксигеназа, когда оба атома кислорода входят в состав продукта (цитохром с оксидаза). Этот центр способен обезвреживать супероксидный и нитритный анионы (рис. 6.22 и схема 45);
 (47)
(47)
3) место связывания иона меди III типа, являясь динуклеарным, состоит из двух ионов меди, мостиком между которыми выступает или молекула кислорода, или гидроксильный анион. Динуклеарный кластер ионов меди III типа обнаружен в гемоцианинах (схема 47), служащих переносчиками кислорода у беспозвоночных, в тирозиназе, участвующей в реакции активации молекулы кислорода и гидроксилировании.
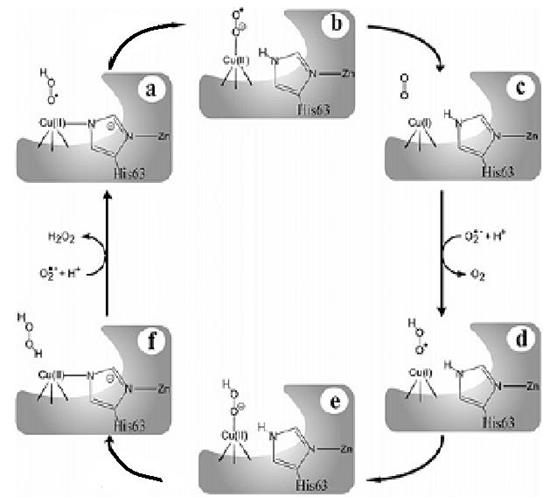
Рис. 6.22. Механизм действия Cu, Zn-супероксиддисмутазы, включающий протонирование супероксидного аниона до взаимодействия с центром связывания иона меди II типа и окислительную координацию во время стадии окисления (согласно MacPherson I.S., Murphy M.E.P. Type-2 copper-containing enzymes // Cell. Mol. Life Sci. 2007. Vol. 64. P. 2887–2899.)
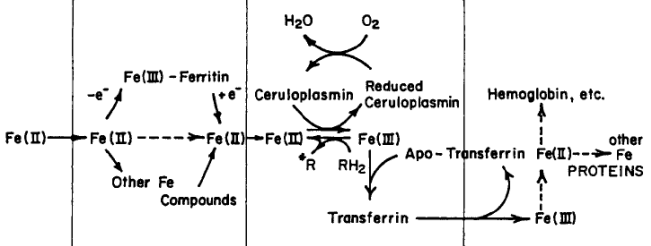
Встречаются более сложно устроенные белки, в которых присутствуют ионы меди разных типов. Например, в мультимедных оксидазах (аскорбатоксидаза) центр связывания иона меди III типа и два иона меди II типа образуют каталитический тринуклеарный кластер. Церулоплазмин, медь-зависимая феррооксидаза, участвующая в метаболизме железа (рис.6.23), содержит 6 ионов меди всех трех типов: три места связывания иона меди I типа, одно − II типа вблизи от двух ионов меди III типа, последние три образуют тринуклеарный кластер, связывающий молекулу кислорода во время каталитического акта (схема 45).
пищева- энтероцит плазма гепатоциты, нейро-
ритель- ны, эритроциты
ный тракт
Рис. 6.23. Роль церулоплазмина как феррооксидазы (RH2 − аскорбат; R – дегидроаскорбат; Нb − гемоглобин (согласно Fox P.L.The copper-iron chronicles: The story of an intimate relation // BioMetals. 2003. Vol. 16. P. 9–40.)
Церулоплазмин окисляет ион Fe2+, высвобождаемый из ферритина, играющего роль центра депонирования железа в организме позвоночных, делая возможным его взаимодействие с трансферрином, переносящим этот ион к месту востребования. Таким образом, дефицит церулоплазмина может приводить к дефициту железа в организме. Кроме участия в метаболизме железа, церулоплазмин оказался белком со многими функциями. Так концентрация белка увеличивается при воспалительных процессах, считают, что это связано с участием церулоплазмина в дезактивации активных форм кислорода.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.