Ион цинка с координационным числом четыре образует комплексы, имеющие тетраэдрическое строение, существуют и октаэдрические комплексы цинка, когда координационное число равно шести. Цинк в большинстве своих комплексов (даже в окислительно-восстановительных реакциях) выступает в качестве сильной кислоты Льюиса, оттягивая на себя электронные пары. В качестве лигандов, взаимодействующих с этим ионом, выступают атомы азота имидазольного кольца гистидина, кислорода карбонильных групп аспарагиновой или глутаминовой кислот, серы цистеина, реже атом кислорода гидроксильной группы тирозина или карбонильных групп аспарагина или глутамина.
Ион цинка в белках может играть каталитичесую или структурную роль. В первом случае он непосредственно занят в каталитическом акте, во втором случае он стабилизирует пространственную структуру белка аналогично дисульфидной связи или, связавшись с регуляторным сайтом, оказывает влияние на протекание ферментативной реакции.
В каталитическом центре ион цинка связан с молекулой воды, которая или ионизуется с образованием гидроксильного иона как в карбоангидразе, или поляризуется как в карбоксипептидазе. В обоих случаях образуется нуклеофил, участвующий в каталитической реакции и атакующий карбонильный углеродный атом пептидной связи, атом углерода в углекислом газе или атом фосфора в фосфатных эфирах. Этот нуклеофил в смешанных комплексах фермент −Zn2+−субстрат или замещается на субстрат, или имеет место увеличение координационной сферы (схема 52). Таким образом каталитическое место связывания цинка характеризуется открытой координационной сферой в отличие от структурного места связывания, где все места вокруг иона Zn2+ заняты аминокислотными остатками (схема 53).
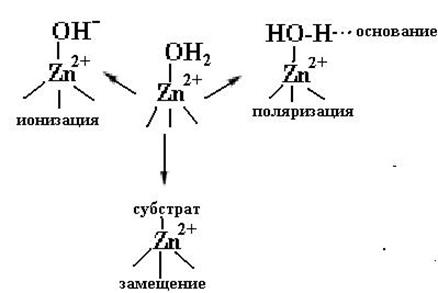 (52)
(52)
Ион Zn2+ в каталитическом месте связан обычно с тремя аминокислотными остатками, это комбинация из остатков гистидина, аспарагиновой или глутаминовой кислот, цистеина, при этом остаток гистидина встречается гораздо чаще других перечисленных остатков, а в структурном сайте связывания цинка, наоборот, преобладают остатки цистеина).
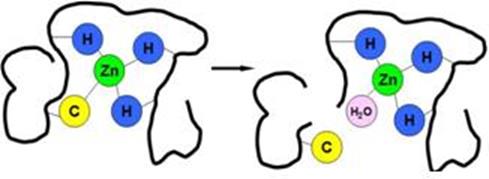
структурное место связывания каталитическое место связывания иона цинка иона цинка (53)
На рис. 6.30 представлены структура активного центра (А) и механизм действия (Б) дрожжевой карбоксиангидразы, катализирующей образование бикарбонатного аниона из углекислого газа и воды с помощью гидроксильного иона, полученного ионизацией молекулы воды под действием иона цинка.
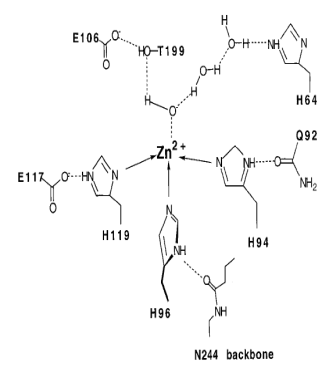
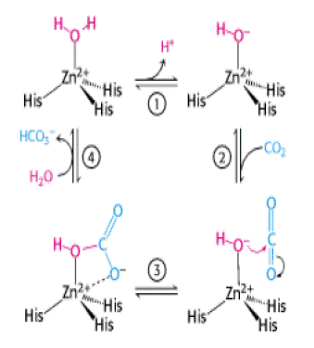
Рис. 6.30. Структура активного центра (А) и механизм действия (Б) дрожжевой карбоксиангидразы (согласно
Структура активного центра и механизм действия цинксодержащих экзопептидаз − карбоксипептидаз подробно описаны в «Части 5. Биохимия процессов пищеварения» п. 5.1.5.2 (стр. 105).
В составе другого цинксодержащего энзима − дрожжевой алкогольдегидрогеназы два иона цинка: один каталитический и один структурный. На рис. 6.31 приведены схемы устройства активного центра дрожжевой алкогольдегидрогеназы (А) и места связывания структурного иона цинка (Б) (этот сайт высоко консервативен для алкогольдегидрогеназ всех классов, что свидетельствует о его особой роли в поддержании пространственной структуры данного фермента).
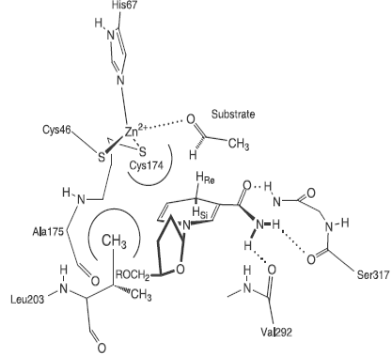
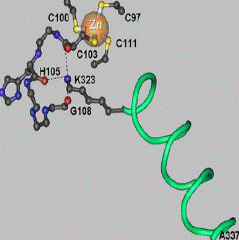
Рис. 6.31. Структурная схема активного центра дрожжевой алкогольдегидрогеназы, катализирующей реакцию восстанавления уксусного альдегида в этанол (А) и места связывания структурного иона цинка (Б) (согласно Weinhold E.G., Glasfeld A., Ellington A.D., Benner S.A. Structural determinants of stereospecificity in yeast alcoholdehydrogenase // Proc. Natl. Acad. Sci. USA. 1991. Vol. 88. P. 8420−8424, Auld D.S. The ins and outs of biological zinc sites // Biometals. 2009. Vol. 22. P. 141–148.)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.