Перенос йодид-аниона через мембрану внутрь фолликула, структурного элемента щитовидной железы осуществляет йодный насос, сопряженный с Na+, K+-АТРазой, совместно с ним переносится ион натрия (рис. 6.32).
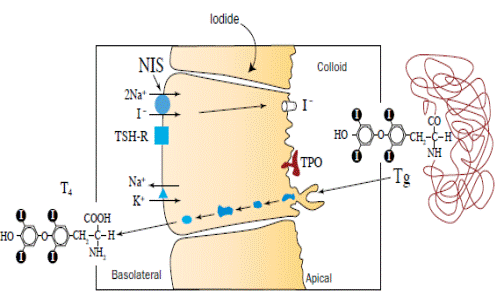
Рис.6.32. Симпорт йодида и иона натрия с помощью йодного насоса (согласно De la Vieja A., Dohan O., Levy O., Carrasco N. Molecular analysis of the sodium/iodide symporter: impact on thyroid and extrathyroid pathophysiology // Physiol. Rev. 2000. Vol. 80. P. 1083−1105.)
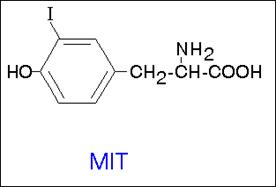
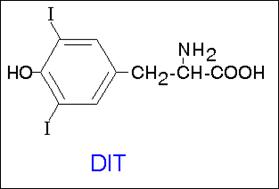
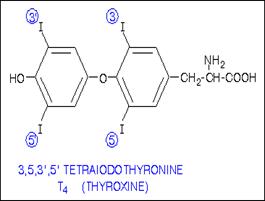
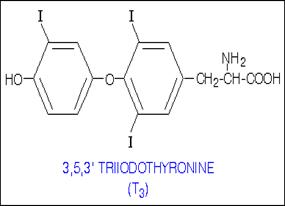
При выходе йодида из эпителиальных клеток фолликула во внутреннее люминальное пространство, занятое коллоидом, происходит окисление йодида тироидпероксидазой (ТРО) с образованием «активного» йода, способного реагировать с остатками тирозина в составе тиреоглобулина, давая MIT и DIT. Последние соединения, вступая в реакцию сопряжения, образуют прогормон тироксин (Т4), подвергающийся дейодированию с образованием гормона щитовидной железы трийодтиронина (Т3) (схема 59).
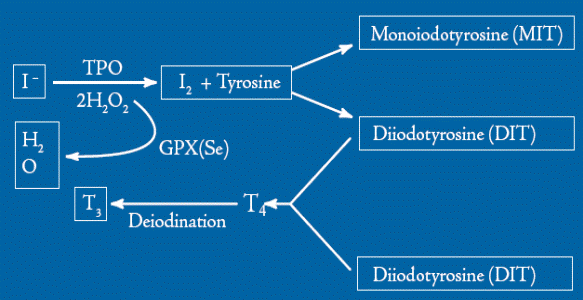 (59)
(59)
Тиреоглобулин (TG) – белок люминального пространства фолликул щитовидной железы молекулярной массой 660 000 Da, служащий местом образования и депонирования тиреоидных гормонов. На рис. 6.33 представлена схема синтеза тиреоглобулина и тиреоидных гормонов в фолликуле щитовидной железы. При поступлении сигнала о необходимости организму тиреоидных гормонов, передаваемому с помощью взаимодействия тиротропина (TSH) с его рецептором в мембране тироцита (TSH-R) (см.рис. 6.33, 1), активируется сначала в ядре тироцита синтез мРНК, кодирующей данный белок (рис. 6.33, 2), а далее трансляция полученной мРНК на рибосомах и пост-трансляционное гликозилирование в эндоплазматическом ретикулуме (ER), приводящее к образованию правильной пространственной структуры белка при фолдинге (рис. 6.33, 3). Правильно свернутый TG поступает в аппарат Гольджи, где подвергается дальнейшему гликозилированию (рис. 6.33, 4), и в виде гомодимера транспортируется в люминальное пространство фолликула. В апикальную мембрану тироцита встроены тироидоксидазы (Тох) и тироидпероксидаза (ТРО), генерирующие Н2О2 и вводящие атомы йода в остатки тирозинов TG, между двумя остатками DIT происходит реакция сопряжения, приводящая к образованию Т4 (рис. 6.33, 5). Комплекс TG-Т4 хранится в люминальном пространстве
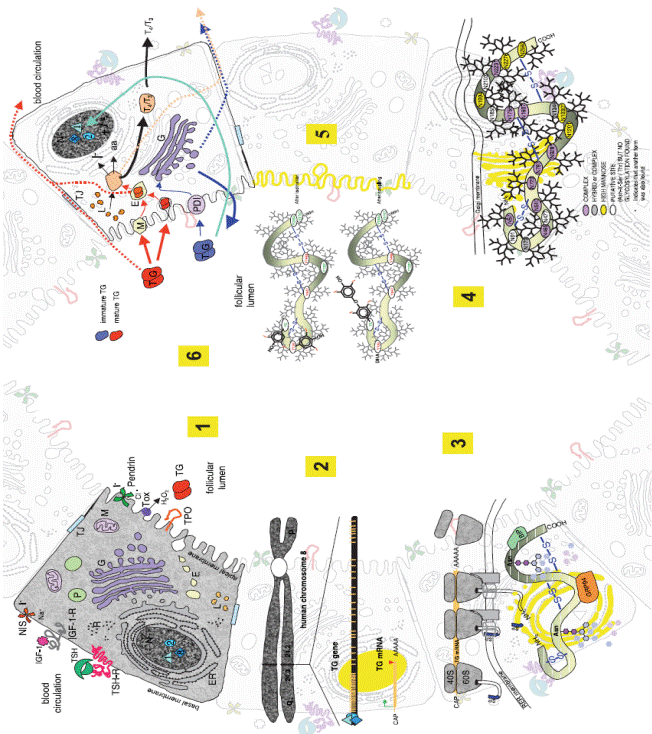
Рис. 6.33. Схема синтеза тироглобулина (TG) и тиреоидных гормонов. 1− взаимодействие тиротропина (TSH) с его рецептором (TSH-R) в мембране тироцита; 2− синтез мРНК TG в ядре тироцита; 3 – синтез TGна рибосомах и фолдинг в эндоплазматическом ретикулуме (ER); 4 – гликозилирование в аппарате Гольджи (G); 5 – йодирование TG в люминальном пространстве фолликул; 6 – частичный протеолиз комплекса TG-Т4 с выходом прогормона в кровяное русло (согласно van de Graaf S.A.R., Ris-Stalpers C., Pauws Е., Mendive F.M., Targovnik Н.М., de Vijlder J.J.M. Up to date with human thyroglobulin // J. Endocrinol. 2001. Vol. 170. P. 307–321.)
фолликул, при востребованности тиреоидных гормонов TG-Т4 поступает в тироцит, происходит частичный протеолиз комплекса и Т4 путем эндоцитоза выбрасывается в кровяное русло (рис. 6.33, 6). Дейодирование Т4 приводит к образованию Т3.
Теперь остановимся поподробнее на некоторых этапах приведенного синтеза.
Введение атомов йода в остатки тирозина TG происходит под действием тироидпероксидазы (ТРО), обладающей двумя активностями. NADPH-оксидаза окисляет NADPH под действием молекулярного кислорода c образованием Н2О2. Взаимодействие последней с йодид-анионом, протекающее в пероксидазном домене, приводит к образованию элементарного йода I2 или, что более вероятно, катиона йодиния, связанного с TРО: Е-I+.
ТРО, мембранный белок, во внеклеточном С-концевом участке которого локализован NADPH-оксидазный домен. Его простетическоя группой является FAD. Внутриклеточный N-концевой домен обладает пероксидазной активностью. Участки, пронизывающие мембрану, содержат в качестве простетических групп два гема, благодаря которым и происходит окисление йодид-аниона. Во внеклеточном участке белка обнаружены две EF-структуры, что указывает на регуляцию активности ТРО ионами Са2+ (рис. 6.34).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.