Распад тирозина до фумарата и ацетоацетата происходит
в печени. Сначала тирозин вступает в реакцию трансаминирования с
α-кетоглутаратом с образованием n-гидроксифенилпирувата и глутаминовой
кислоты. Реакцию катализирует пиридоксаль-зависимый фермент
тирозинаминотрансфераза. При окислении n-гидроксифе-нилпирувата с помощью
n-гидроксифенилпируватдиоксигеназы имеет место декарбоксилирование,
гидроксилирование ароматического ядра и миграция боковой цепи, что приводит к
образованию
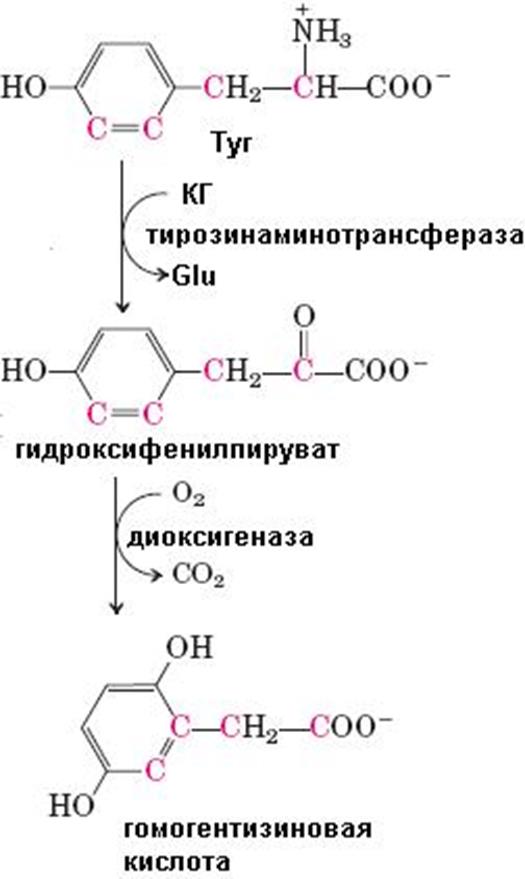
(продолжение схемы 65 на стр. 106)
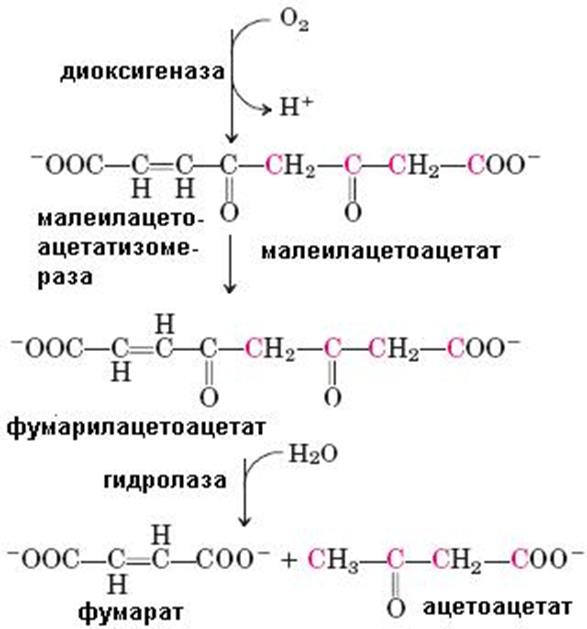 (65)
(65)
гомогентизиновой кислоты. Кофакторами в этой реакции являются витамин С и ион Fe2+. Под действием диоксигеназы гомогентизиновой кислоты, содержащей ион Fe2+, происходит расщепление ароматического кольца с образованием малеилацетоацетата, изомеризующегося в фумарилацетоацетат, гидролиз которого с помощью фумарилацетоацетатгидролазы приводит к высвобождению фумарата и ацетоацетата (схема 65). Оба конечных продукта могут окисляться в ЦТК до СО2 и Н2О.
В щитовидной железе из тирозина синтезируются гормоны: тироксин и трийодтиронин (см. п. 6.1.9.4). В меланоцитах тирозин превращается в пигменты меланины. Это сложный многоступенчатый процесс, начинающийся с превращения тирозина в диоксифенилаланин (ДОФА) под действием тирозиназы, использующей в качестве кофактора ионы Cu+. Аналогичная реакция протекает в надпочечниках и нервной ткани при синтезе катехоламинов. Фермент, катализирующий эту реакцию в надпочечниках и в нервной ткани, отличается от тирозиназы, является зависимым от ионов Fe2+, аналогично фенилаланингидроксилазе для протекания этой реакции в качестве кофактора необходим тетрагидробиоптерин (синтез катехоламинов будет подробно рассмотрен в Части 7. Молекулярные механизмы межклеточной химической сигнализации).
6.2.2. Полиеновые жирные кислоты. В организме важную роль играют липиды, основная масса которых представлена триацилглицеролами, являющимися в сущности формой депонирования энергии. В состав липидов входят насыщенные и ненасыщенные жирные кислоты. В организме человека это в основном жирные кислоты с четным числом атомов углерода, а по конфигурации двойных связей в ненасыщенных жирных кислотах это цис-изомеры (т. е. ацильные фрагменты находятся по одну сторону двойной связи), что делает алифатическую цепь жирной кислоты изогнутой и приводит к снижению температуры плавления (рис. 6.41). Жирные кислоты с транс-конфигурацией двойной связи, обнаруживаемые, например, в маргаринах, могут поступать в организм человека с пищей. У них отсутствует излом, они имеют более высокую температуру плавления и более твердые по консистенции.
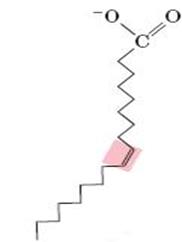
Рис. 6.41. Пространственная структура
мононенасыщенной олеиновой кислоты с
цис-конфигурацией двойной связи между
атомами углерода 9 и 10
Большинство жирных кислот синтезируется в организме, но есть и незаменимые (эссенциальные) жирные кислоты, синтез которых в организме отсутствует. Это линолевая и α-линоленовая кислоты. Они должны поступать с пищей.
Длинные жирные кислоты синтезируются в эндоплазматическом ретикулуме в основном из стеариновой кислоты путем удлинения ее с помощью малонилСоА. Процесс протекает аналогично синтезу пальмитиновой кислоты: перенос двууглеродного фрагмента от малонилСоА на стеарилСоА, восстановление кетогруппы до гидроксильного остатка с помощью NADPH, дегидратация и восстановление двойной связи с образованием насыщенной жирной кислоты, удлиненной на двууглеродный фрагмент. Отличие лишь в том, что остаток стеарила связан не с ацил-переносящим белком синтазы жирных кислот, а просто с СоА.
Процесс введения двойных связей в жирные кислоты называется десатурацией. Этот процесс происходит в эндоплазматическом ретикулуме в присутствии молекулярного кислорода, NADH, цитохрома b5 и FAD-зависимой цитохром b5 редуктазы. Атомы водорода, отщепляемые от жирной кислоты, восстанавливают один из атомов молекулярного кислорода с образованием молекулы воды (схема 66). Электроны для восстановления второго и выделения также в виде воды поставляет гем цитохром b5, ион Fe2+ которого окисляется до Fe3+. Восстановление окисленной формы цитохрома b5 происходит под действием NADH и FAD-зависимой цитохром b5 редуктазы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.