В настоящее время подробно изучены два патологических процесса, связанных с метаболизмом меди: синдром Менке (дефицит поступления меди в клетки) и синдром Вильсона (избыточный транспорт и токсикоз). Оба заболевания связаны с мутациями в генах, кодирующих белки-транспортеры меди в мембранах клеток или органелл. При синдроме Менке наблюдается неврологическая дегенерация, слабая регуляция температурного режима организма и смертность во младенческом возрасте. При синдроме Вильсона медь не способна выделяться с желчью, встраиваться в белки, такие как церулоплазмин; она накапливается в печени, приводя к циррозу.
6.1.8.3. Марганец. Этот переходный металл также является важным микроэлементом для живых организмов. Марганец поступает в организм в виде соединений Мn2+ и Mn4+, имеет существенное значение в развитии скелета, энергетическом метаболизме, функционировании нервной и иммунологической систем, активации некоторых ферментов и защите организма от действия активных форм кислорода. В мозге Мn2+ выступает в качестве кофактора в реакциях биосинтеза и метаболизма нейротрансмиттеров.
Три основные метаболические функции иона марганца заключаются в: 1) активации ключевых ферментов глюконеогенеза − пируваткарбоксилазы и изоцитратдегидрогеназы; 2) защите митохондриальных мембран с помощью Mn-супероксиддисмутазы; 3) активации гликозилтрансферазы при синтезе полисахаридов. Дефицит марганца приводит к изменениям в метаболизме углеводов, в том числе глюкозы, и липидов, к нарушениям синтеза и функционирования инсулина.
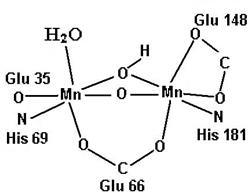
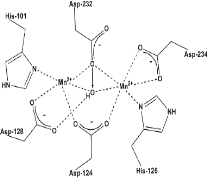
Рис. 6.24. Динуклеарные Mn-содержащие активные центры каталазы Lactobacillusplantarum и аргиназы из печени крысы (согласно Barynin V.V., Whittaker M.M., Antonyuk S.V., Lamzin V.S., Harrison P.M., Artymiuk P.J., J.W. Whittaker Crystal structure of manganese catalase from Lactobacillusplantarum // Structure. 2001. Vol. 9. P. 725–738; Ash D.E. Structure and Function of Arginases // J. Nutr. 2004. Vol. 134. P. 2760S–2764S.)
Ионы марганца участвуют не только в реакции инактивации супероксидного аниона, катализируемой Mn-супероксиддисмутазой, но и в разложении пероксида водорода под действием негемовой каталазы, в которой место кофактора, переносящего электроны, занимает динуклеарный Mn-содержащий активный центр. Этот центр функционирует в двух состояниях: восстановленном [Mn2+−Mn2+] и окисленном [Mn3+−Mn3+] (см. рис. 6.24). Похожий центр обнаружен также и в аргиназе, катализирующей гидролиз аргинина с образованием орнитина в цикле мочевины (рис. 6.24).
Ионы марганца, как известно, принимают участие в синтезе молекулы кислорода в растительных клетках. Эту реакцию осуществляет водоокисляющий комплекс фотосистемы II, содержащий четыре иона марганца и один ион кальция. На рис.6.25 представлено два возможных механизма образования молекулы кислорода: а) депротонирование кислородного атома одной молекулы воды под действием сильного окислителя − Mn4-кластера и образование сильноэлектрофильного атома кислорода, подвергающегося нуклеофильной атаке атомом кислорода второй молекулы воды, связанной в координационной сфере иона кальция; б) альтернативный механизм предполагает после депротонирования молекулы воды образование
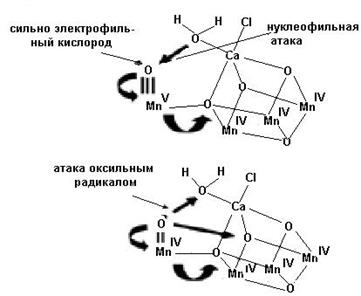
Рис. 6.25. Предполагаемые механизмы образования молекулы кислорода при функционировании водоокисляющего комплекса фотосистемы II (согласно Barber J. Photosynthetic generation of oxygen // Phil. Trans. R. Soc. B. 2008. Vol. 363. P. 2665–2674.)
из кислородного атома на окисляющем Mn4-кластере радикала, атакующего или кислород в составе второй молекулы воды, или кислород, связывающий ионы кальция и марганца, с образованием молекулы кислорода.
Ионы Mn2+ присутствуют в качестве кофактора в реакции окислительного декарбоксилирования изоцитрата, катализируемой изоцитратдегидрогеназой. Образуя координационные связи с кислородными атомами концевой карбоксильной и соседней с ней гидроксильной групп, Mn2+ облегчает отрыв атомов водорода (схема 48).
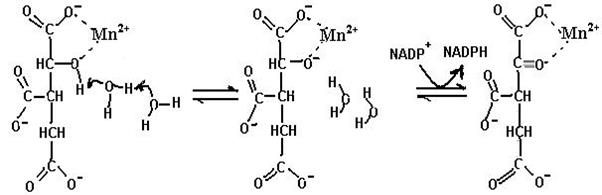 (48)
(48)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.