 (31)
(31)
После переноса восстановительных эквивалентов Fe-белок диссоциирует из комплекса, а восстановленный Mo-Fe-белок связывает N2 в кластере, названном FeMo-кофактор [7Fe–9S–Mo–X−гомоцит- рат] (Х по расчетам может быть атомом углерода, азота или кислорода) и локализованном на α-субъединицах тетрамера, и последовательно восстанавливает молекулярный азот до NH3. На рис. 6.6 представлена пространственная структура нитрогеназы Azotobacter vinelandii.
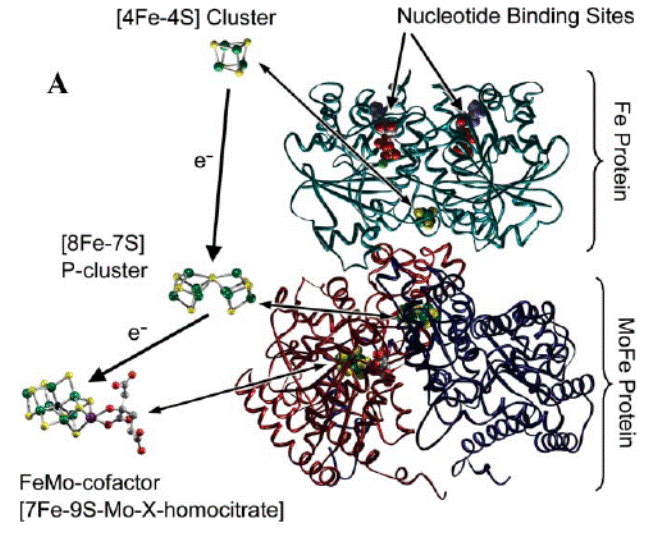
Рис. 6.6 Пространственная структура нитрогеназы Azotobacter vinelandii. Зелёным показан Fe-белок, синим и фиолетовым — MoFe-белок. Fe-белок содержит сайт связывания нуклеотида (АТР) и [4Fe−4S] кластер для переноса восстановительных эквивалентов, MoFe-белок через Р-кластер [8Fe−7S], соединяющий α- и β-субъединицы в димерах, передает электроны на FeMo-кофактор [7Fe–9S–Mo–X−гомоцитрат], локализованный на α-субъединицах. На рисунке изображена половина нитрогеназного комплекса: один Fe-белок и αβ-структура из α2β2-тетрамера MoFe-белко-вого кофактора (согласно Barney B. M., Lee H.-I., Dos Santos P. C., Hoffman B. M., Dean D. R., Seef L. C.Breaking the N2 triple bond: insights into the nitrogenase mechanism// Dalton Trans. 2006. P. 2277–2284.)
Каталитический центр Mo-Fe-белкового кофактора основан на [4Fe−3S] кластере, связанном тремя сульфидными связями с [Mo–3Fe–3S] субкластером, гомоцитрат координирован с ионом молибдена через два атома кислорода (схема 32) (положение аминокислотных остатков приведено для нитрогеназы Klebsiella pneumoniae). Молекула азота связывается четырьмя ионами железа.
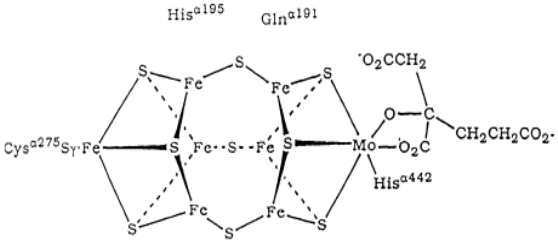 (32)
(32)
Показано, что Fe-белок не только переносит восстановительные эквиваленты от ферридоксина (флаводоксина) к FeMo-кофактору, но и необходим при сборке Mo-Fe-белкового кофактора для встраивания комплекса Мо-гомоцитрат в предшественник кофактора, не содержащий иона молибдена. В его отсутствие активный Mo-Fe-белковый кофактор не образуется.
Нитрогеназа обладает низкой субстратной специфичностью и вместо азота может восстанавливать другие соединения с тройной связью: ацетилен (на этом её свойстве основан метод определения активности азотфиксации), цианиды и азиды (также параллельно с образованием водорода).
Выше мы упоминали, что восстановление молекулы азота происходит последовательно. На рис. 6.7 представлен цикл азотфиксации. Видно, что сначала восстанавливается один атом азота, потом другой, что отличается от реакций, приведенных на схеме 29. Пока неясно, какая из схем более правильно описывает процесс восстановления молекулярного азота до иона аммония.
В 1980−90 годы у ряда бактерий (Azotobacter chroococcum, Az. vinelandii, Az. paspalii, Anabaena variabilis, Rhodobacter capsulatus) обнаружены формы нитрогеназы, содержащие вместо иона молибдена ионы ванадия, вольфрама или железа, они встраиваются в фермент при дефиците молибдена. Эти ферменты устроены аналогично нитрогеназе, содержащей ион молибдена. Их уникальным свойством является способность восстанавливать ацетилен в этан, в то время как Мо-нитрогеназа восстанавливает ацетилен в этилен.
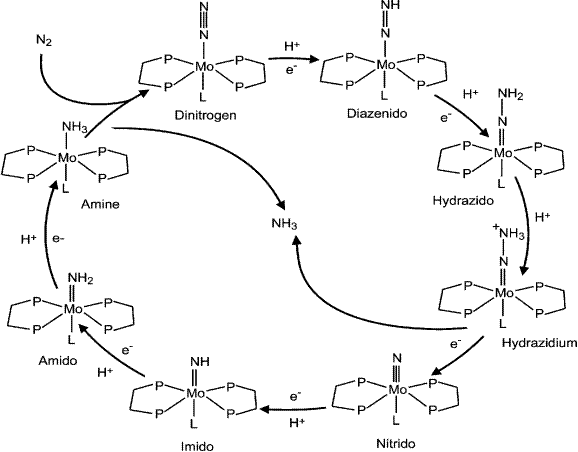
Рис. 6.7. Цикл восстановления молекулярного азота нитрогеназой (согласно Barney B. M., Lee H.-I., Dos Santos P. C., Hoffman B.M.,Dean D.R., Seef L.C.Breaking the N2 triple bond: insights into the nitrogenase mechanism // Dalton Trans. 2006. P. 2277–2284.)
В 1997 г. у термофильных бактерий (Streptomyces thermoautotrophicus) была открыта супероксид-зависимая (СОЗ) нитрогеназа. Проблемой функционирования всех металл-содержащих нитрогеназ является инактивация при контакте с кислородом. Организмы создали разнообразные системы защиты от инактивации нитрогеназы кислородом: 1) разделение во времени процессов фотосинтеза и азотфиксации, например процесс азотфиксации протекает ночью в отсутствие освещения, 2) создание дифференцированных клеток−гетероцист с анаэробными или микроаэробными условиями. СОЗ-нитрогеназа в отличие от других нитрогеназ не только не инактивируется в атмосфере кислорода, но и требует его присутствия для проявления активности. Другое ее отличие: она трехкомпонентна. Хотя активность «альтернативных» нитрогеназ составляет не более 10 % от активности Мо-нитрогеназы, наличие этих ферментов позволяет азотфиксаторам вести процесс при низком содержании молибдена, что характерно для многих типов почв.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.