G=H – TS, (198)
где Н – энтальпия;
S – энтропия системы.
Если система может находиться в нескольких состояниях, то устойчивым будет то из них, для которого свободная энергия минимальна. Таким образом, фазовое превращение происходит, если оно сопровождается уменьшением свободной энергии системы
ΔG=ΔH-TΔS<0. (199)
Изменение энтальпии ΔH системы в результате превращения равно тепловому эффекту с обратным знаком: если превращение идет с выделением тепла, то ΔH<0, и наоборот. Так, при затвердевании жидкости всегда выделяется так называемая скрытая теплота плавления λ. В этом случае величина ΔH численно равна λ и отрицательна. Напротив, при плавлении ΔH>0 тепло поглощается. Аллотропические превращения также сопровождаются тепловыми эффектами. Например, превращение белого олова (тетрагональная решетка) в серое (решетка алмаза) при 130 С сопровождается выделением теплоты ΔH=-2,1 кдж/г-атом (-500 кал/г-атом).
ΔG=ΔU+PΔV, (200)
где ΔU – изменение внутренней энергии системы.
Для конденсированных систем ΔH![]() ΔU.
Изменение внутренней энергии системы включает изменение кинетической и
потенциальной энергии. Так, отрицательное значение ΔH при
переходе белого олова в серое, очевидно, означает, что внутренняя энергия
последнего ниже и, следовательно, атомы в нем связаны прочнее. Выяснение причин
этого требует рассмотрения большого числа различных факторов.
ΔU.
Изменение внутренней энергии системы включает изменение кинетической и
потенциальной энергии. Так, отрицательное значение ΔH при
переходе белого олова в серое, очевидно, означает, что внутренняя энергия
последнего ниже и, следовательно, атомы в нем связаны прочнее. Выяснение причин
этого требует рассмотрения большого числа различных факторов.
Второй член в правой части выражения (199) – это изменение энтропии системы. В термодинамике энтропия вводится формально через «приведенное тепло»:
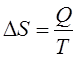 , (201)
, (201)
где ![]() – тепло, полученное системой при обратимом изменении ее
состояния).
– тепло, полученное системой при обратимом изменении ее
состояния).
Для изотермического превращения изменение энтропии равно изменению теплосодержания ΔH, деленному на температуру:
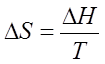 .
(202)
.
(202)
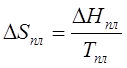 .
(203)
.
(203)
Поскольку
при плавлении тепло поглощается, ![]() >0, энтропия
системы растет,
>0, энтропия
системы растет, ![]() >0. Напротив, при кристаллизации
энтропия уменьшается
>0. Напротив, при кристаллизации
энтропия уменьшается ![]() <0 (на ту же
величину, на какую возрастает при плавлении).
<0 (на ту же
величину, на какую возрастает при плавлении).
Согласно
второму принципу термодинамики, самопроизвольный процесс в изолированной
системе происходит, если энтропия возрастает. Таким образом, в этой системе
кристаллизация никогда не могла бы произойти, грубо говоря, потому, что некуда
было бы отводить тепло. Однако в реальных условиях плавящееся тело не является
изолированным (тепло можно отводить и подводить) и истинным критерием процесса
является не энтропия, а свободная энергия. Процесс происходит, если![]() < 0. При
< 0. При ![]() изменение
свободной энергии
изменение
свободной энергии
![]() . (203)
. (203)
Поскольку
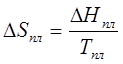 , то
, то ![]() =
0. Соответственно и
=
0. Соответственно и ![]() =0.
=0.
Таким образом, при ![]() жидкая
и твердая фазы находятся в равновесии. Однако достаточно небольшого
переохлаждения, чтобы кристаллизация произошла (если не учитывать необходимости
создания зародыша критического размера). Действительно, если
жидкая
и твердая фазы находятся в равновесии. Однако достаточно небольшого
переохлаждения, чтобы кристаллизация произошла (если не учитывать необходимости
создания зародыша критического размера). Действительно, если ![]() , а
, а ![]() , то
можно считать, что
, то
можно считать, что ![]() и
и ![]() практически
не меняются, поэтому
практически
не меняются, поэтому
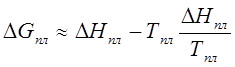 > 0 (напомним, что
> 0 (напомним, что ![]() > 0). (204)
> 0). (204)
При кристаллизации
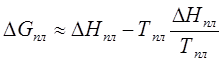 <
0,
<
0, ![]() , (205)
, (205)
но ![]() <0 (
<0 (![]() ),
т. е. устойчивым становится твердое состояние. Поскольку его свободная энергия
меньше.
),
т. е. устойчивым становится твердое состояние. Поскольку его свободная энергия
меньше.
Аналогично можно
рассчитать ![]() при аллотропическом
превращении. Превращение α-железа (о.ц.к.) в γ-железо (г.ц.к.) при 910 0С
сопровождается поглощением тепла 0,9 кдж/г-атом (215 кал/г-атом).
Следовательно, молярная энтропия γ-железа больше, чем α-железа на
величину
при аллотропическом
превращении. Превращение α-железа (о.ц.к.) в γ-железо (г.ц.к.) при 910 0С
сопровождается поглощением тепла 0,9 кдж/г-атом (215 кал/г-атом).
Следовательно, молярная энтропия γ-железа больше, чем α-железа на
величину 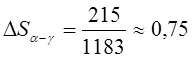 дж/ (гpад×г-атом) [0,18 кал/(гpад×г-атом)]. Энтропия серого олова
меньше чем белого
дж/ (гpад×г-атом) [0,18 кал/(гpад×г-атом)]. Энтропия серого олова
меньше чем белого 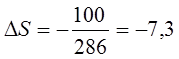 дж/ (гpад×г-атом) [-1,75 кал/ (гpад . г-атом)].
дж/ (гpад×г-атом) [-1,75 кал/ (гpад . г-атом)].
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.