Так в системе серебро – кадмий при концентрации кадмия 40 % (ат.) С =1,4.
В идеальном растворе, в котором либо нет взаимодействия компонентов, либо взаимодействие всех компонентов приблизительно одинаково, все свойства компонентов выражаются через их концентрацию. В реальных растворах появляется новая термодинамическая переменная – активность компонента в растворе аi. Если раствор приближается к идеальному, например, при разбавлении, то активность становится равной концентрации, тогда как в общем случае ai ≠ Ci. Физически активность характеризует стремление компонента покинуть фазу (раствор) и, следовательно, взаимодействие компонентов в растворе и степень его отклонения от идеальности. Коэффициент активности γi =аi/Ni, для идеального раствора γi=1. Если γi>1, говорят о положительных отклонениях от идеальности: компонент менее охотно растворяется, взаимодействие носит характер отталкивания. Такие отклонения должны приводить к ограниченной растворимости и даже полному ее отсутствию. Напротив, γi<1 означает, что компонент охотно входит в раствор; взаимодействие – положительно (притяжение).
Типичные кривые, изображающие зависимость активности от концентрации (молярной доли), для жидких сплавов показаны на рисунке 70. Положительные отклонения имеют место в системах, в которых смешивание компонентов сопровождается поглощением тепла (Pb-Cd, Cd-Sn, Cd-Zn, Sn-Zn и др.). Отрицательные – напротив, в системах, где при смешивании компонентов тепло выделяется (Ag-Cd, Ag-Mg, Au-Zn, Cu-Znи др.).
Сплавы могут содержать различные фазы, имеющие определенный химический состав и термодинамические свойства и отделенные от других фаз поверхностью раздела. В металлических сплавах могут существовать твердые растворы, промежуточные фазы и химические соединения.
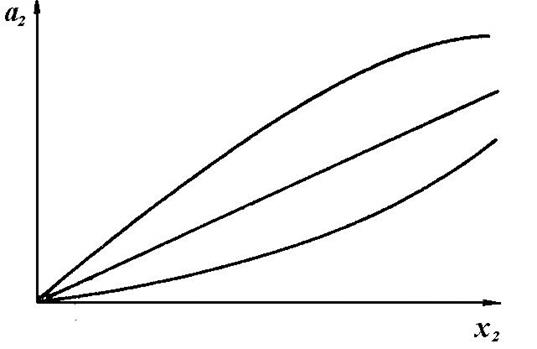
1 – идеальный раствор;
2 – положительные отклонения; 3 – отрицательные отклонения
Рисунок 70 – Зависимость активности второго компонента (а2) в бинарной системе от концентрации (молярной доли, x2)
Твердый раствор представляет собой однородную атомарную смесь двух или более компонентов, состав которой может непрерывно изменяться без нарушения гомогенности. В некоторых системах твердые растворы существуют во всем интервале составов: от одного чистого металла до другого. В таких системах компоненты неограниченно растворяются друг в друге. Однако в большинстве случаев область гомогенности ограничена. Химические соединения также являются однородными, однако они характеризуются строго заданным составом. При растворении одного из (или обоих) компонентов в некотором химическом соединении образуется твердый раствор (или промежуточная фаза) на основе химического соединения.
Для того чтобы решить, какое состояние является более устойчивым – гомогенное или смесь фаз, – надо оценить величины соответствующих свободных энергий. Если сплав существует в виде фазовой смеси двух чистых компонентов А и В, то его свободная энергия определяется точкой F пересечения линии состава СС' с прямой, соединяющей свободные энергии каждого компонента FА и FВ (рисунок 71). Образование фазовой смеси из твердых растворов вместо чистых компонентов приведет к понижению свободной энергии. Так, если состав растворов определяется точками А1 и В1, то свободная энергия смеси будет F1<F. По мере увеличения растворимости, т.е. по мере сближения точек А и В (А2 и В2 и т.д.), величина свободной энергии будет понижаться. В конце концов точки А и В сливаются и свободная энергия становится минимальной F3, что соответствует образованию гомогенного твердого раствора между компонентами системы.
Отметим, что эта энергия минимальна даже в том случае, если одна из фаз имеет энергию, меньшую, чем F3, например А2. Дело в том, что энергия второй фазы В2 в этом случае столь велика, что свободная энергия смеси F2 больше свободной энергии гомогенного раствора F3.
В рассмотренном случае, когда состояние твердого гомогенного раствора данной системы определяется простой U-образной кривой свободной энергии (d2F/dC2 положительна на всем протяжении кривой), любая прямая, соединяющая две точки на кривой, лежит выше той части кривой, концы которой она соединяет и, следовательно, гомогенный раствор более стабилен, чем фазовая смесь.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.