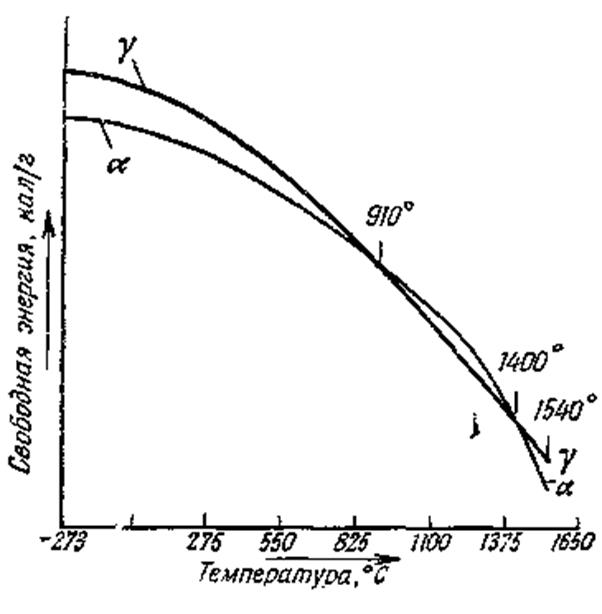
Рисунок 92 – Зависимость величины свободной энергии от температуры для α-Fe и γ-Fe
При низких температурах энергетически устойчиво α-олово, имеющее тетрагональную кубическую решетку. Это валентный кристалл характеризуется ковалентным типом связи, которая наиболее прочна, и поэтому форма валентного кристалла оказывается энергетически выгодной при низких температурах. Поскольку ковалентная связь образуется путем попарного соединения атомов и парами обобщенных электронов, этот тип связи характеризуется строгой направленностью и жесткостью. Большая прочность и жесткость приводит к тому, что тепловое возбуждение атомов валентных кристаллов происходит труднее, чем в структурах с менее прочной связью, поэтому удельная теплоемкость α-олова относительно мала, и вследствие своей сильно выраженной направленности ковалентная связь сильно ослабляется тепловым возбуждением.
Если металл, в котором может происходить полиморфное превращение, нагревается или охлаждается настолько медленно, что все время успевает устанавливаться равновесное состояние, то превращение должно быть полностью обратимо и совершаться при одной и той же температуре при нагревании и охлаждении. В практике к истинному равновесию придти очень трудно, поэтому наличие гистерезиса – общее правило для превращений в твердом состоянии.
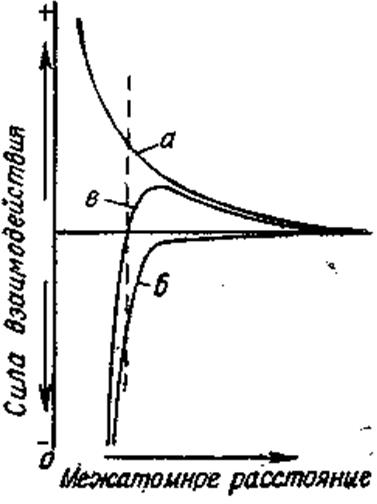
Рисунок 93 – Межатомные притяжение и отталкивание как функция межатомного расстояния (схема)
Существует ряд причин, по которым при полиморфных превращениях обычно имеется заметное отклонение от равновесия. Важно отметить, что процессы изменения кристаллической структуры характеризуются очень большими значениями энергии активации. Это приводит к тому, что вблизи равновесной температуры эти процессы идут довольно медленно.
До тех пор пока расстояние между атомами велико по сравнению с размерами атомов электростатическое притяжение между ними мало, и с уменьшением расстояния оно возрастает почти равномерно (кривая а). Сближению атомов мешает возрастающая по мере уменьшения межатомного расстояния сила отталкивания между ядрами и электронами (кривая б). Взаимное отталкивание двух атомов резко возрастает, когда атомы сближаются настолько, что их электронные орбиты начинают перекрываться (резкий перегиб на кривой б). Такое резкое, практически неограниченное возрастание силы отталкивания на близких расстояниях объясняется принципом Паули.
Алгебраическая сумма силы притяжения (с положительным знаком) и силы отталкивания (с отрицательным знаком) дает силу результирующего взаимодействия атомов (кривая в). Ход кривой показывает, что свободные атомы, находящиеся на относительно большом расстоянии от кристалла, притягиваются к нему. По мере их приближения результирующая сила притяжения сначала увеличивается, а затем уменьшается и достигает нуля в точке, где притяжение и отталкивание равны между собой. Дальнейшее сближение соседних атомов приводит к увеличению отталкивания, которое стремится возвратить атомы в равновесное состояние. В результате атомы в кристаллической решетке располагаются на определенном отдалении один от другого – межатомном расстоянии и противодействуют любому перемещению, приводящему к увеличению или уменьшению этого расстояния.
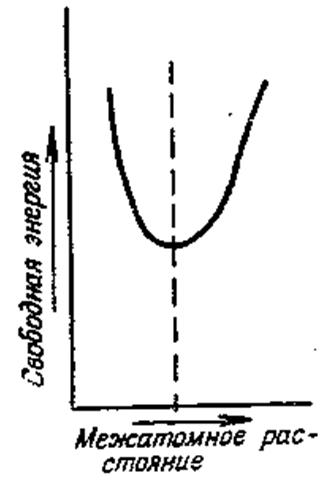
Рисунок 94 – Изменение величины свободной энергии в зависимости от межатомного расстояния в кристалле (пунктиром показано равновесное состояние)
Следует отметить, что в любой кристаллической структуре смещение атомов из положения равновесия связано с возрастанием его потенциальной анергии и, следовательно, свободной энергии кристалла в целом. Схематически указанное положение изображено на рисунке 94, где показано возрастание свободной энергии атома при увеличении или уменьшении межатомного расстояния. Если могут существовать две различные кристаллические структуры с равными свободными энергиями, что бывает всегда при равновесной температуре, то для каждой из этих структур справедливо положение о росте потенциальной энергии и свободной энергии кристалла в целом.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.