Чистые металлы, существующие в двух полиморфных модификациях – железо, никель, кобальт, вольфрам, титан, бор, бериллий, уран, цирконий, родий, скандий, таллий, церий, лантан и празеодим.
Чистые металлы, имеющие три полиморфные модификации – хром, кальций, литий, селен.
Марганец существует в четырех полиморфных модификациях.
В электролитических осадках и в образцах, подвергнутых очень высокому давлению, можно получить дополнительные модификации у некоторых металлов.
Полиморфные превращения имеются также в сплавах на основе вышеупомянутых металлов. При этом модификация обозначается такой же греческой буквой, что и для чистого основного металла.
Теоретические обоснования существования полиморфизма.
Полиморфизм – вполне закономерное явление для кристаллического состояния.
По мере повышения температуры выше 0° К уменьшается свободная энергия любой возможной полиморфной формы. Для различных форм это уменьшение свободной энергии происходит с неодинаковой скоростью. Быстрее убывает свободная энергия модификации с наибольшей удельной теплоемкостью. Можно предполагать, что устойчивая кристаллическая структура обладает наименьшей теплоемкостью, поскольку межатомные связи в этом случае наиболее прочны. Поэтому свободная энергия стабильной модификации уменьшается с возрастанием температуры менее быстро.
При температурах выше Тк свободная энергия β-формы становится меньше, чем α-формы; следовательно, выше этой температуры β-форма является устойчивой модификацией. Плавление может произойти раньше, чем станет возможным полиморфное превращение (кривая L пересекает кривую α при температуре ниже Тк в точке Тп). При нагреве может происходить α→β превращение, за которым, возможно, следует плавление β-формы при более высокой температуре Тп, если точка Тп лежит выше Тк.
Не исключена возможность существования γ-, δ-, ε-модификаций того же вещества. Для каждой из них свободная энергия должна уменьшаться с возрастанием температуры. Если не произойдет плавления, такое положение должно привести к появлению второго полиморфного перехода при некоторой температуре выше Тк; возможны даже третье, четвертое и т.д. превращения.
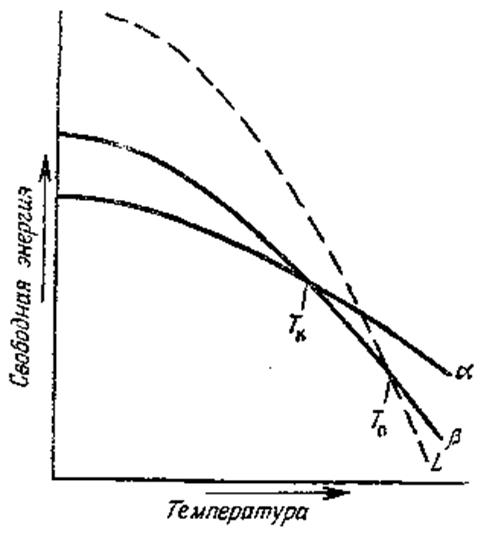
Рисунок 91 – Зависимость величины свободной энергии
от температуры для α- и β-модификаций кристаллического твердого тела и соответствующей жидкости (L)
Например, область устойчивости о.ц.к.-железа простирается от 0° К до 910° С, а далее происходит переход в г.ц.к.-железо. γ-Fe устойчиво до 1400° С, а затем снова переходит в о.ц.к.-Fe (δ-Fe) В действительности эта форма тождественна с α-формой. Выше этой температуры (1400° С) δ-Fe устойчиво вплоть до температуры плавления. При очень высоких температурах становится заметной теплоемкость электронного газа. Увеличение вклада электронов в полную теплоемкость свидетельствует о возбуждении некоторых из них, находящихся на частично занятых переходных уровнях атомов железа. Это происходит не только вследствие особой природы самих атомов железа, но также и в результате их электростатического взаимодействия с окружающими атомами, определяемого характером данной кристаллической структуры.
Необходимо отметить, что полиморфное превращение в любом металле при нагреве сопровождается поглощением, а при охлаждении – выделением тепла. При температуре равновесия свободные энергии обеих полиморфных форм должны быть равны. Поэтому при отсутствии значительного переохлаждения или перегрева изменение свободной энергии приблизительно равно 0. Так как ΔH=ΔF+TΔS, причем ΔF=0, то теплота превращения ΔH, выделяемая или поглощаемая при превращении, является следствием изменения энтропии ΔS. Вследствие того, что направление процесса определяется знаком изменения энтропии (что непосредственно связано с теплоемкостью), справедливо положение, согласно которому при повышении температуры устойчива модификация, средняя теплоемкость которой вблизи температуры превращения больше.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.