Огромный скачок в исследованиях
процессов клеточного возбуждения был достигнут после того, как в лабораторную
практику внедрили методику фиксации мембранного потенциала, предложенную Коулом
в 1949 г. Суть ее заключается в том, что функция двух переменных ![]() - проводимость мембраны сводилась к
функции одной переменной (времени) путем фиксации второй (мембранного потенциала)
на постоянном уровне. Путем перебора некоторого количества фиксированных
уровней удавалось получать семейство функций, параметром которого был
потенциал. Успешные результаты применения этой методики связаны еще и с тем
обстоятельством, что к этому времени были развиты исследования, основанные на
технике меченых атомов, а также получена возможность независимого изучения проводимости
каналов определенных типов ионов путем блокировки проводимости других. В
частности, натриевые каналы блокировались тетродотоксином, а калиевые –
тетраэтиламмонием. Кроме этого, использовались также приемы, связанные с
изменением состава раствора, окружающего клетку: ионы, способные пройти через
мембранные поры, заменялись на ионы, не способные к этому (например, Na+ в межклеточной жидкости заменялся на ионы холина). Таким
образом удавалось выделить ту или иную составляющую общего ионного тока.
- проводимость мембраны сводилась к
функции одной переменной (времени) путем фиксации второй (мембранного потенциала)
на постоянном уровне. Путем перебора некоторого количества фиксированных
уровней удавалось получать семейство функций, параметром которого был
потенциал. Успешные результаты применения этой методики связаны еще и с тем
обстоятельством, что к этому времени были развиты исследования, основанные на
технике меченых атомов, а также получена возможность независимого изучения проводимости
каналов определенных типов ионов путем блокировки проводимости других. В
частности, натриевые каналы блокировались тетродотоксином, а калиевые –
тетраэтиламмонием. Кроме этого, использовались также приемы, связанные с
изменением состава раствора, окружающего клетку: ионы, способные пройти через
мембранные поры, заменялись на ионы, не способные к этому (например, Na+ в межклеточной жидкости заменялся на ионы холина). Таким
образом удавалось выделить ту или иную составляющую общего ионного тока.
Технической основой метода фиксации мембранного потенциала явились микроэлектродные зонды (в основном в виде стеклянных микропипеток) и электронная следящая система. На рис. 8 приведена упрощенная структурная схема этих экспериментов.
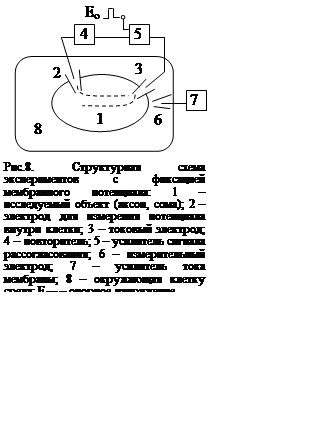 Внутрь исследуемого элемента
клетки (сомы, аксона) 1 вводятся два микроэлектрода 2, 3. Во внешней среде 8
находится еще один микроэлектрод 6. Информация о потенциале внутри клетки,
полученная с помощью микроэлектрода 2, поступает на повторитель напряжения 4,
служащий для согласования относительно высокого сопротивления цепи «цитоплазма
– микроэлектрод» с низким входным сопротивлением усилителя 5. Усилитель 5 –
дифференциальный. На один из его входов подается опорное напряжение
Внутрь исследуемого элемента
клетки (сомы, аксона) 1 вводятся два микроэлектрода 2, 3. Во внешней среде 8
находится еще один микроэлектрод 6. Информация о потенциале внутри клетки,
полученная с помощью микроэлектрода 2, поступает на повторитель напряжения 4,
служащий для согласования относительно высокого сопротивления цепи «цитоплазма
– микроэлектрод» с низким входным сопротивлением усилителя 5. Усилитель 5 –
дифференциальный. На один из его входов подается опорное напряжение ![]() , на другой – напряжение в
цитоплазме. Разность этих напряжений усиливается и формирует выходное
напряжение, под действием которого в цепи электрода 3 протекает ток. Разность
входных напряжений, при которой выходное напряжение еще будет заметно отлично
от нуля, определяется соотношением
, на другой – напряжение в
цитоплазме. Разность этих напряжений усиливается и формирует выходное
напряжение, под действием которого в цепи электрода 3 протекает ток. Разность
входных напряжений, при которой выходное напряжение еще будет заметно отлично
от нуля, определяется соотношением ![]() , где U1 и U2
– напряжения на входах дифференциального усилителя (в нашем случае это
, где U1 и U2
– напряжения на входах дифференциального усилителя (в нашем случае это ![]() и напряжение цитоплазмы),
и напряжение цитоплазмы), ![]() - коэффициент усиления усилителя 5,
- коэффициент усиления усилителя 5, ![]() - напряжение его питания,
- напряжение его питания, ![]() - напряжение на выходе, максимальное
значение которого не может превысить напряжения питания. Из соотношения
следует, что при достаточно большом
- напряжение на выходе, максимальное
значение которого не может превысить напряжения питания. Из соотношения
следует, что при достаточно большом ![]() можно считать
можно считать ![]() . Таким образом, изменяя скачком
уровни опорного напряжения, можно исследовать характер зависимостей ионных
токов от времени при заданном значении параметра – напряжения на мембране. При
этом основным требованием к цепям, формирующим мембранный потенциал, является
требование малости постоянной времени установления напряжения на мембране после
подачи скачка опорного напряжения в сравнении с длительностью процессов изменения
ионных проводимостей мембран (последние характеризуются временами порядка
единиц миллисекунд). Для дифференциального усилителя это требование сводится к
большой ширине полосы усиливаемых частот (или малости времени установления), а
для цепей электродов – к малости времени установления потенциала цитоплазмы. В
тех случаях, когда исследуемый объект является достаточно протяженным, т.е. процесс
установления потенциала приобретает волновой характер из-за конечной скорости
распространения возмущения, зонды 2 и 3 заменяют на металлические проводники,
введенные в объем цитоплазмы и тем самым способствующие увеличению скорости
распространения сигнала (проводники показаны пунктирными линиями на рис. 8).
Чаще вводят лишь один проводник, используя его в качестве токового электрода 3.
. Таким образом, изменяя скачком
уровни опорного напряжения, можно исследовать характер зависимостей ионных
токов от времени при заданном значении параметра – напряжения на мембране. При
этом основным требованием к цепям, формирующим мембранный потенциал, является
требование малости постоянной времени установления напряжения на мембране после
подачи скачка опорного напряжения в сравнении с длительностью процессов изменения
ионных проводимостей мембран (последние характеризуются временами порядка
единиц миллисекунд). Для дифференциального усилителя это требование сводится к
большой ширине полосы усиливаемых частот (или малости времени установления), а
для цепей электродов – к малости времени установления потенциала цитоплазмы. В
тех случаях, когда исследуемый объект является достаточно протяженным, т.е. процесс
установления потенциала приобретает волновой характер из-за конечной скорости
распространения возмущения, зонды 2 и 3 заменяют на металлические проводники,
введенные в объем цитоплазмы и тем самым способствующие увеличению скорости
распространения сигнала (проводники показаны пунктирными линиями на рис. 8).
Чаще вводят лишь один проводник, используя его в качестве токового электрода 3.
 Таким образом, после очередного
скачкообразного увеличения опорного напряжения
Таким образом, после очередного
скачкообразного увеличения опорного напряжения ![]() из-за
значительной разницы между сигналами на входах дифференциального усилителя на
его выходе появляется напряжение большого уровня, которое вызывает ток через
мембрану, приводящий к изменению ее заряда и доведению его до уровня, при котором
потенциал мембраны оказывается практически равным опорному напряжению и стабилизируется
на нем. Ионные токи, возникающие вследствие изменения мембранного потенциала,
фиксируются измерительной цепью, содержащей электрод 6 и усилитель 7.
из-за
значительной разницы между сигналами на входах дифференциального усилителя на
его выходе появляется напряжение большого уровня, которое вызывает ток через
мембрану, приводящий к изменению ее заряда и доведению его до уровня, при котором
потенциал мембраны оказывается практически равным опорному напряжению и стабилизируется
на нем. Ионные токи, возникающие вследствие изменения мембранного потенциала,
фиксируются измерительной цепью, содержащей электрод 6 и усилитель 7.
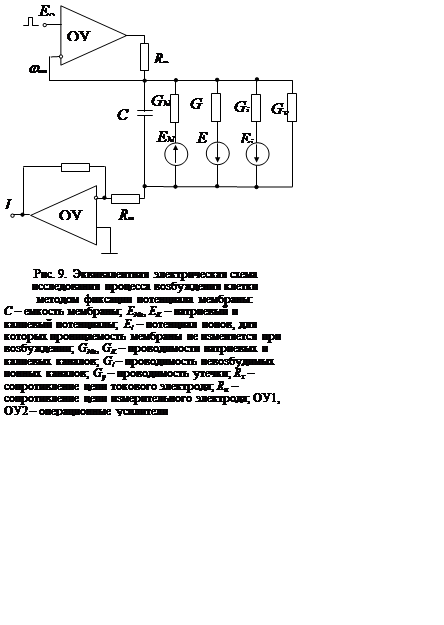
При исследовании переходных
процессов на мембране необходим учет ее емкости. Это отражено на эквивалентной
электрической схеме устройства для исследования методом фиксации мембранного
потенциала (рис. 9). Мембрана на эквивалентной схеме моделирована параллельным
соединением пяти ветвей – одной емкостной и четырех резистивных. Емкостная
ветвь характеризует реактивные токи мембраны. Ветви, содержащие проводимости ![]() , отражают активные токи. Калиевые и
натриевые каналы являются возбудимыми, и их проводимости изменяются во времени
при каждом новом скачке потенциала мембраны. Проводимость
, отражают активные токи. Калиевые и
натриевые каналы являются возбудимыми, и их проводимости изменяются во времени
при каждом новом скачке потенциала мембраны. Проводимость ![]() не зависит ни от потенциала
мембраны, ни от времени и моделирует транспорт ионов, имеющих концентрационный
градиент на мембране и невозбудимые ионные каналы. Ветвь
не зависит ни от потенциала
мембраны, ни от времени и моделирует транспорт ионов, имеющих концентрационный
градиент на мембране и невозбудимые ионные каналы. Ветвь ![]() характеризует токи ионов с
одинаковыми концентрациями в объеме по обе стороны мембраны и также невозбудимыми
каналами.
характеризует токи ионов с
одинаковыми концентрациями в объеме по обе стороны мембраны и также невозбудимыми
каналами.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.