Качественный анализ минеральной воды
После прогревания прибора в стаканчик наливают 20см3 дистиллированной воды и устанавливают его под капилляр распылителя. Через смотровое окно наблюдают за окраской пламени горелки и заключают о присутствии какого-либо из катионов.
Количественный анализ катионов
натрия, калия, кальция в минеральной воде
Изменение концентраций натрия, калия и кальция начинается с построения градуированных кривых, которые строятся для каждого элемента отдельно по эталонным растворам.
Эталонные растворы готовят из стандартных растворов содержащих:
Кальция-2г/дм3, калия-0,2г/дм3, натрия-0,2 г/дм3.
В мерных колбах объемом в 100 см3 приготавливают эталонные растворы, содержащие 2,4,.6 и 8 мкг/см3 ионов натрия; 20, 40, 60, 80 мкг/см3 ионов калия и 0,2; 0,4; 0,6 и 0,8 мкг/см3 ионов кальция.
Построение градуировочной кривой (рис.13)
Выбор диапазона измерения начинают с наимее чувствительного-5-ого, распыляя дистиллированную воду, ручкой “установка нуля” стрелку микроамперметра устанавливают на “0” шкалы. Далее, распыляя эталонный раствор максимальной концентрации стрелку микроамперметра ручкой “чувствительность” ставят на деление 100. Снова распыляют дистиллированную воду, при этом стрелка микроамперметра должна вернуться на “0”. Если она не возвращается, ее устанавливают на “0” ручкой “установка нуля”. Затем повторно фотометрируют эталонный раствор максимальной концентрации. Если стрелка не установилась на деление 100 шкалы, ее устанавливают ручкой “чувствительность”.
Далее фотометрируют эталонные растворы определяемого элемента известной, равномерно возрастающей концентрации. Каждой концентрации будет соответствовать определенное отклонение стрелки. Число растворов должно быть достаточным для построения нескольких точек градуировочной кривой, в координатах: концентрация растворов в мкг/см3 – на абсциссе, показания прибора в миллиампереах на ординате (рис.13).
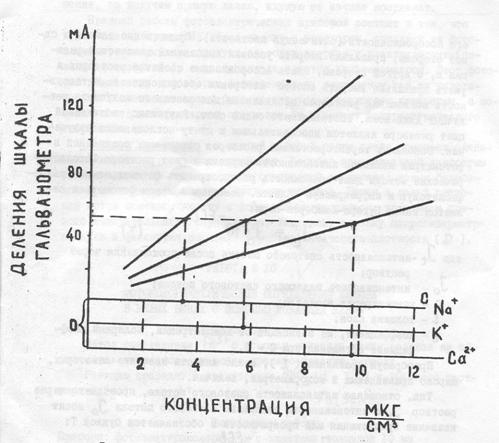
Рис. 13 Градуировочная зависимость
Фотоэлектроколориметрический метод анализа
Фотоколориметрический (фотоэлектроколориметрический) метод является модификацией известного метода колориметрии, где определяемый компонент с помощью химической реакции в растворе переводят в соединение, поглощающее электромагнитное излучение, затем измеряют его абсорбционность (оптическую плотность). Существенно важно, с одной стороны, правильно выбрать условия выполнения химической реакции и, с другой стороны, знать абсорбционные свойства растворов и уметь правильно выбрать способ измерения абсорционности. Интенсивность поглощения раствором неодинакова для светового излучения различных длин волн, составляющего белый свет. Визуально наблюдаемый цвет раствора является дополнительным к цвету поглощенного излучения. Основными характеристиками растворов окрашенных соединений в фотометрии являются интенсивность окраски и цвет раствора. Фотоэлектрические методы дают возможность распространить фотометрию на ультрафиолетовую и инфракрасную области. Основным законом фотометрии является закон Бугера-Ламберта-Бера:
Jt=J0
. 10-εC![]() (1)
(1)
где Jt – интенсивность светового потока после прохождения через раствор;
J0 – интенсивность падающего светового потока;
C- концентрация вещества;
![]() - толщина слоя;
- толщина слоя;
ε – коэффициент, не зависящий от концентрации, молярный коэффициент погашения при C=1.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.