Затем вновь калибруют шкалу в этом диапазоне, устанавливая стрелку на красной метке (как указано выше). Затем освобождают кнопку и отсчитывают по шкале значения удельной электропроводности раствора до начала титрования. Результаты заносят в лабораторный журнал.
Затем, включив мешалку, начинают титрование, приливая в стаканчик щелочь из бюретки по 0,5 см3; при этом записывают показания прибора. Сделав еще три замера после точки эквивалентности, титрование прекращают.
По полученным данным строят кривую титрования и находят ТЭ. Для этого на оси абсцисс откладывают объемы стандартного раствора щелочи, идущей на титрование (отсчет по шкале бюретки), на оси ординат – соответствующие им значения удельной электропроводности (отсчет по шкале кондуктометра). Из точки пересечения двух ветвей на ось абсцисс опускают перпендикуляр; полученное значение (см3) подставляют в формулу:
Нкисл. = ![]() ,
,
где Vкисл., Нкисл. – объем (см3) и нормальность раствора кислоты,
Носн. – нормальность раствора щелочи (0,1 н. стандартный раствор),
Vосн. – объем щелочи, пошедшей на титрование, см3
х(μS)
![]()
25
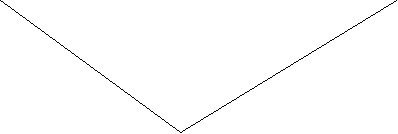 |
20
15
10
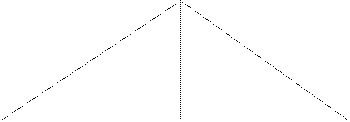 |
5
0 т.э.
![]() 1 2 3 4 5 6
7 8 9 10 V
1 2 3 4 5 6
7 8 9 10 V
(титранта)
см3
Рис. 11. Кривая титрования сильной кислоты
неизвестной концентрации сильным основанием
Вопросы для самопроверки
1. От таких факторов зависит величина окислительно – восстановительного потенциала
2. Какие электроды используются при измерении потенциала (Э.Д.С.).
3. Почему потенциал хингидронного электрода является обратной химической функцией рН раствора.
4. Объясните почему потенциал электродов сравнения (каломельный хингидронный при постоянной, температуре есть величина постоянная.)
5. Как определяют активную и общую кислотность пищевых систем.
6. От чего зависит ход кондуктометрических кривых.
7. Как рассчитывают величины удельной, эквивалентной и мольной электропроводности. В каких единицах они измеряются.
8. С помощью каких электродов измеряют концентрацию ионов ионометрическим методом анализа. Какие электроды являются при этом индикаторными.
9. Сущность ионометрического метода определения нитратов.
10. Вольт – амперометрические методы анализа. Классификация.
11. Сущность полярографического метода анализа. Система электродов.
12. Какие характеристики можно рассчитать с помощью уравнения Ильковича.
13. Что такое остаточный, диффузионный и кинетические токи в полярографии.
14. Приведите характерную зависимость величины тока от напряжения. Какую качественную характеристику несет эта зависимость.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.