Работа 1. Определение содержания серной кислоты
Реагенты
Щавелевая кислота H2C2O4 · 2H2O; 0,1 н. раствор (первичный стандарт) (или КОН); 0,1 н. раствор (вторичный стандарт, титрант)
Гидроксид натрия – NaOH
Индикатор – фенолфталеин.
Установление концентрации раствора NaOH
Концентрацию (N,Т) NaOH устанавливают по первичному стандартному раствору исходного вещества, например, по щавелевой кислоте. Щавелевая кислота диссоциирует по двум ступеням:
H2C2O4 ↔ H+ + HC2O-4 (pK1 = 1,25)
HC2O-4 ↔ H+ + C2O2-4 (pK2 = 4,27)
Значения рК сравнительно мало отличаются друг от друга, поэтому при титровании водных растворов щавелевой кислоты гидроксидом натрия реакция протекает по уравнению:
H2C2O4 + 2ОН- ↔ C2O2-4 + 2Н2О
Из уравнения следует, что грамм – эквивалент H2C2O4· 2Н2О равен:
ЭМщ.к. = ![]()
Вследствие гидролиза образующегося оксалата натрия в ТЭ раствор должен быть
щелочным. При титровании 0,1 н. раствор должен быть щелочным. При титровании
0,1 н. раствора щавелевой кислоты 0,1 н. раствором гидроксида натрия в ТЭ рН =
8,55. Следовательно, для этого случая титрования пригоден фенолфталеин
(интервал перехода рН = 8 ![]() 10).
10).
Бюретку тщательно промывают водой и дважды ополаскивают приготовленным раствором NaОН; затем, подставив под нее колбу или стакан, открывают зажим и заполняют раствором оттянутый кончик бюретки, чтобы в нем не оставалось пузырьков воздуха. Устанавливают уровень NaOН в бюретке на нуле. Дважды ополаскивают пипетку стандартным раствором щавелевой кислоты, после чего отмеренные пипеткой 10 мл раствора щавелевой кислоты переносят в коническую колбу. К раствору щавелевой кислоты прибавляют 2-3 капли индикатора фенолфталеина и титруют при непрерывном перемешивании раствором гидроксида натрия до тех пор, пока в перемешанном после прибавления капли NaOH растворе бледно-розовая окраска будет сохраняться около 30 секунд.
Титрование проводят не менее трех раз до получения сходящихся результатов (отсчеты должны различаться не более, чем на ± 0,1 мл). По результатам титрования нахордят среднее значение, по которому рассчитывают точную концентрацию титранта NaOH по формуле:
nщ.к. = nNaOH
Nщ.к. · Vщ.к. = NNaOH · VсрNaOH
NNaOH = 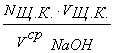 .
.
TNaOH = ![]() , г/мл
, г/мл
Определение содержания серной кислоты в растворе
Получив в мерной колбе некоторое количество раствора серной кислоты, доводят объем дистиллированной воды до метки и тщательно перемешивают раствор. Ополаскивают пипетку приготовленным раствором серной кислоты, отбирают пипеткой 10 мл этого раствора в коническую колбу и добавляют 2-3 капли фенолфталеина. Титрант- раствор гидроксида натрия NaOH – наливают в бюретку и устанавливают уровень раствора на нуле. Кончик бюретки заполняют раствором NaOH. Раствор кислоты титруют при перемешивании раствором NaOH до неисчезающего в течение 30 секунд бледно – розового окрашивания. Титрование повторяют 2-3 раза.
Расчет производят по формулам:
n![]() = n
= n![]() ;
;
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.