Решение. Алюминиевая бронза - сплав меди с алюминием.
![]() =
0.338 В,
=
0.338 В, ![]() =
-1,700 В. Так как
=
-1,700 В. Так как ![]() >
>![]() , то кристаллиты
меди в этом сплаве будут катодными участками, а алюминия - анодными. Последние
и будут подвергаться разрушению и в случае а), и в случае б). Катодные процессы
определяются характером (составом) коррозионной среды. В случае а) это будет
коррозия с водородной деполяризацией, в случае б) - с кислородной деполяризацией:
, то кристаллиты
меди в этом сплаве будут катодными участками, а алюминия - анодными. Последние
и будут подвергаться разрушению и в случае а), и в случае б). Катодные процессы
определяются характером (составом) коррозионной среды. В случае а) это будет
коррозия с водородной деполяризацией, в случае б) - с кислородной деполяризацией:
а) Коррозионные процессы, идущие на алюминиевой бронзе в дистиллированной воде.
(-)A(Al): Al ® Al+3 + 3e;
(+)K(Cu): 2H2O + 2e ® H2 + 2OH-;
2Al + 6H2O ® 3H2 + 2Al(OH)3¯
б) Коррозионные процессы, идущие на алюминиевой бронзе в растворе NaOH.
(-)A(Al): Al ® Al+3 + 3e;
(+)K(Cu): O2 + 2H2O + 4e ® 4OH-;
4Al + 3O2 + 6H2O ® 4Al(OH)3¯
Из приведенных суммарных реакций видно, что продуктами коррозии являются: в случае а) водород и гидроксид алюминия, не растворяющийся в дистиллированной воде, в случае б) - гидроксид алюминия, растворяющийся в избытке щелочи по реакции:
Al(OH)3 + NaOH ® Na[Al(OH)4]
С учетом этой реакции анодный процесс в щелочной среде может быть описан уравнением: (-)A(Al): Al + 4OH- ® [Al(OH)4]- + 3e;
Пример 8. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадет в кислую среду (НСl)? Дайте схему образующегося при этом гальванического элемента.
Решение. Сравниваем стандартные потенциалы соответствующих металлов:
![]() =-0.744 В,
=-0.744 В, ![]() = 0.337 В. Для данной пары хром
является более активным металлом и в образующейся гальванической паре будет
анодом. Медь является катодом. Хромовый анод растворяется с окислением хрома, а
на медном катоде выделяется водород.
= 0.337 В. Для данной пары хром
является более активным металлом и в образующейся гальванической паре будет
анодом. Медь является катодом. Хромовый анод растворяется с окислением хрома, а
на медном катоде выделяется водород.
Схема работающего гальванического элемента:
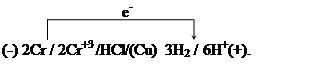 |
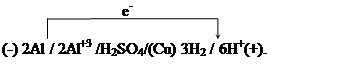 Пример 9. При
нарушении целостности поверхностного слоя медного покрытия на алюминии
происходит коррозия вследствие работы гальванопары:
Пример 9. При
нарушении целостности поверхностного слоя медного покрытия на алюминии
происходит коррозия вследствие работы гальванопары:
За 45 с работы этой гальванопары на катоде выделилось 0.09 л водорода (измеренного при н.у.). Сколько граммов алюминия растворилось за это время и какую силу тока дает эта гальванопара?
Решение. Максимальная сила тока, даваемая гальваническим элементом за единицу времени, определяется следующим соотношением:
I = mF/mЭ,
где I - сила тока, в А; m - масса растворившегося за 1 с более активного электрода или выделившегося за 1 с вещества на катоде; F - постоянная Фарадея; mЭ - эквивалент элемента, из которого сделан более активный электрод, или эквивалент элемента, выделяющегося на катоде. За 1 с на катоде выделяется:
0.09/45 = 0.002 л. H2.
Гальванический элемент дает ток силой:
I = mF/mЭ = 0.002×96500/11.2 = 17.2 A.
Эквивалент алюминия равен 9. За 45 с работы гальванопары алюминия растворилось:
mAl = 9×17.2×45/96500 = 0.072 г.
Пример 10. Будет ли серебро корродировать с
водородной деполяризацией в деаэрированном растворе NaCN, pH которого равен 10,
а активности CN- и [Ag(CN)2]-
- ионов составляют соответственно 0.316 и 0.0001 моль/л, a ![]() = -0.31
В.?
= -0.31
В.?
Решение. Коррозия будет происходить, если для коррозионного микрогальванического элемента Е > 0, электродные реакции которого в соответствии с условием можно описать следующими уравнениями:
(-)A: Ag + 2CN- ® [Ag(CN)2]- + e;
(+)K: 2H2O + 2e ® H2 + 2OH-;
Рассчитаем потенциал анода в соответствии с уравнением Нернста:
![]() =
= ![]() +0.059lg
+0.059lg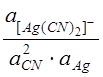 = -0.487 В
= -0.487 В
Катодный процесс - процесс, лежащий в основе работы водородного электрода, потенциал которого зависит от рН и рассчитывается по уравнению
![]() = -0.059×pH = -0.059×10 = -0.59 В.
= -0.059×pH = -0.059×10 = -0.59 В.
Отсюда E = jk - ja = -0.59 – (-0.487) = -0.103 В.
Так как E < 0, то коррозия серебра невозможна.
Пример 11. Цинк и медь корродируют в морской воде со скоростью 1 г./(м2∙сут). Определите скорость коррозии в мм/год, если rZn = 7130 кг /м3,. rCu = 8920 кг /м3.
Решение. Глубинный (П) и массовый (Кмасс) показатели скорости коррозии связаны соотношением: П = Kмасс×365/r, где r - плотность металла в кг/м3. Подставляя числовые значения, получаем:
ПZn = 1×365/7130 = 0.051 мм/год
ПCu = 1×365/8920 = 0.041 мм/год
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.