При наличии контакта металла и электролита, вследствие гетерогенности электролита и металлической поверхности на последней появляются участки с различными электродными потенциалами (Рис. 1.1.), которые являются электродами короткозамкнутых гальванических элементов (участки металлов разделены слоем электролита и имеют непосредственный контакт).
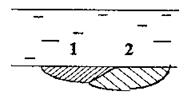
Рис. 1.1. Схема появления коррозионной гальванической пары. j1 > j2; 1- катод; 2 – анод.
На участках с более отрицательными значениями электродных потенциалов, являющихся анодами, протекает анодный процесс окисления металла Me = Me+n + ne, а точнее - образование гидратированных ионов металла в электролите и некомпенсированных электронов в металле:
Me + mH2O = Me+n×mH2O + ne.
На участках с более положительными значениями электродных
потенциалов, являющихся катодами, протекает процесс восстановления, при этом
происходит присоединение электронов ионами или молекулами - окислителями,
называемыми деполяризаторами (D):
D + ne ® [Dne].
Одновременно происходит перемещение электронов по металлу от анодных участков к катодным, а катионов и анионов в растворе. В большинстве случаев катодными деполяризаторами являются растворенный в электролите кислород воздуха или ионы водорода, которые восстанавливаются на катоде по уравнениям:
в нейтральных и щелочных средах:
O2 + 4e + 2H2O = 4OH- (1)
2H2O + 2e = H2 + 2OH- (2)
в кислых средах:
O2 + 4e + 4H+ = 2H2O (3)
2H+ + 2e = H2 (4)
Деполяризаторами могут быть: Cl2, Fe+3, NO3- и другие.
Принципиальная возможность протекания процесса электрохимической коррозии определяется следующими соотношениями:
DG < 0; jA
< jK;
jOX
> jRed;
jA
< ![]() ;
;
то есть, для электрохимического растворения металла необходимо присутствие окислителя-деполяризатора, равновесный потенциал которого положительнее равновесного потенциала металла в данных условиях. При соблюдении этого условия:
jK - jA > 0, а DG = -nF(jK - jA) < 0
Для определения катодного процесса необходимо сравнить
равновесные потенциалы коррозирующего металла и водородного или кислородного
электрода. Если jMe<![]() , на катоде в основном восстанавливается
водород по реакциям (2) или (4), если
, на катоде в основном восстанавливается
водород по реакциям (2) или (4), если ![]() > jMe >
> jMe > ![]() ,
на катоде восстанавливается только кислород по реакциям (1) и (3).
,
на катоде восстанавливается только кислород по реакциям (1) и (3).
Например, при коррозии цинка в соляной кислоте, так как jZn<![]() , идут процессы:
, идут процессы:
Zn = Zn+2 + 2e - окисление цинка на анодных участках;
2H+ + 2e = H2 - восстановление на катодных участках.
При коррозии меди в соляной кислоте потенциал меди (см. приложение) положительнее равновесного потенциала водородного электрода, и в этом случае идут процессы:
O2 + 4e + 4H+ = 2H2O восстановления кислорода на катодных участках;
Cu = Cu+2 + 2e окисление меди на анодных участках.
Коррозионная стойкость металлов и сплавов в значительной степени зависит от рН раствора, состава и концентрации нейтральных электролитов. На устойчивость металлов и сплавов влияют продукты коррозии в виде солевых и оксидных пленок на поверхности металла. Если пленка пористая и легко отделяется от металла, она не проявляет защитных свойств (коррозия железа в атмосфере); на поверхности других металлов (алюминия, титана, хрома) образуются плотные оксидные пленки с высокими защитными свойствами, предохраняющими эти металлы от дальнейшей коррозии.
Выполнение работы
1. Приборы, посуда и реактивы: спиртовка, штатив, набор микропробирок, фильтрованная и наждачная бумага, гвоздь, мел, уротропин, металлы (Zn, Cu, Al, Pb, стальная пластина); растворы H2SO4 – 0.2 н., HCl - 1 н., CuSO4 – 0.5 н., NaCl - 3%, Cu(NO3)2 – 2%, CH3COOH- 0.5 н., KJ – 0.5 н., K3[Fe(CN)6] - 5 н.
2. Схема установки
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.