Аммиакатные (хлористые) электролиты просты по составу, устойчивы в работе, обладают хорошей рассеивающей способностью и высоким выходом по току (близким к теоретическому значению). Цинк на катоде выделяется при pН = 8
Цинковые покрытия дополнительно хроматируют в растворах состава 1 или 2.
Таблица 6.1. Составы растворов для хроматирования.
|
Раствор 1 |
Раствор 2 |
||
|
Na2Cr2O7 |
100¸150 г/л |
Na2Cr2O7 |
25¸35 г/л |
|
H2SO4 |
8¸10 г/л |
HNO3 |
4¸7 г/л |
|
Na2SO4×10H2O |
9-15 г/л |
||
|
Время обработки, с |
5¸20 |
Время обработки, с |
30¸60 |
Выполнение работы.
1. Приборы, посуда и реактивы:
Опыт 1: Установка для нанесения покрытий, растворы электролитов для никелирования (состав растворов приведен в таблице 6.2.), раствор для кулонометра, раствор для определения пористости покрытия, стальной образец, кулонометр, наждачная и фильтровальная бумага, весы.
Опыт 2: Установка для нанесения покрытий, аноды цинковые 2 шт., электроды медные – 2 шт., стальной образец, кулонометр, наждачная и фильтровальная бумага, весы, раствор состава (г/л): ZnSO4×7Н2О - 215, Al2(SO4)3×8Н2О - 30, К2SО4·10Н2О – 50, декстрин – 10, раствор для кулонометра, ацетон.
2. Схема установки
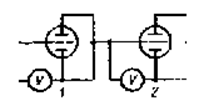
Рис.6.1. Схема установки для изучения процесса получения гальванопокрытий:
1 – электролизер, 2 – медный кулонометр.
Опыты проводятся на установке, схема которой приведена на Рис. 6.1. Установка состоит из электролизера для никелирования - 1, медного кулонометра - 2, источника постоянного тока, регулируемого сопротивления, амперметра и вольтметров. Электролизер представляет собой лабораторный стакан на 250 или 500 см3, к крышке которого прикреплены два никелевых анода с клеммами. Между анодами к крышке крепится образец, подлежащий никелированию.
Медный кулонометр представляет собой лабораторный стакан объемом 250 или 500 см3 с сернокислым электролитом меднения и двумя медными анодами. Между анодами к крышке крепится катод - образец для меднения.
3. Последовательность выполнения работы
3.1. Электролитическое никелирование и определение пористости покрытия.
3.1.1. Соберите установку (Рис. 6.1). Не включая внешнюю цепь, залейте в электролизер для никелирования один из растворов (Таблица 6.2.). Значение рН раствора должно лежать в пределах 5.0÷5.5.
Таблица 6.2. Растворы для никелирования.
|
Компоненты раствора |
Концентрация, г/л |
|
|
раствор 1 |
раствор 2 |
|
|
NiSO4×7Н2О |
250 |
200 |
|
NiС12×6Н2О |
30 |
- |
|
NаС1 |
- |
5-10 |
|
Nа2SО4×10Н2О |
- |
30 |
|
Н3В03 |
30 |
30 |
3.1.2. В кулонометр 2 залейте водный раствор состава (г/л): СuSО4×5Н2О - 250; H2SO4 - 50. Стальной образец обезжирьте в ацетоне, промойте, зачистите наждачной бумагой, еще раз промойте, просушите фильтровальной бумагой и взвесьте. Закрепите в зажимах токоподвода электролизера и, включив внешнюю цепь, погрузите образец в электролизер никелирования между анодами. В кулонометр между анодами погрузите медный образец, приготовленный таким же образом, как и образец для никелирования.
3.1.3. Электролиз проводите при катодной плотности тока 200 a/м2 в течение 20¸30 мин. Затем, вынув образцы из электролизеров, промойте их проточной водой, просушите фильтровальной бумагой и взвесьте. Во время электролиза запишите показания вольтметров на электролизерах. Результаты опыта оформите в Таблице 6.2.
3.1.4. Определите пористость покрытия, нанесенного на стальную пластинку, путем наложения на нее фильтровальной бумаги, пропитанной раствором состава (г/л): К3[Fe(CN)6] - 10 и NaС1 - 20. Время выдержки - 10 мин. Пористость выразите через число пятен, образующихся на единице площади поверхности бумаги. Объясните, почему на фильтровальной бумаге образуются пятна.
3.1.5. Обработка результатов опыта.
Приведите возможные реакции на катодах и анодах электролизеров.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.