СВОИСТВА ИОНОВ КАРБЕНИЯ каталитического крекинга.Наиболее признанной теорией, объясняющей механизм реакций каталитического крекинга, является карбений-ионная. В соответствии с этой теорией первым актом реакции является образование иона карбения при взаимодействии исходных углеводородов с кислотными активными центрами катализаторов и далее протекают различные превращения этого иона. Ионы карбения (карбокатионы) – это частицы с недостатком электронов, содержащие положительно заряженный атом углерода (СnH2n+1+).
Ионы карбения из олефинов и ароматических углеводородов образуются путем присоединения к ним протона при взаимодействии их с протонными кислотными активными центрами.
![]()
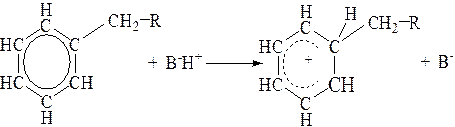
Из насыщенных углеводородов ионы карбения образуются
путем отрыва от молекулы гидрид-иона (![]() ) при взаимодействии их с апротонными кислотными
активными центрами.
) при взаимодействии их с апротонными кислотными
активными центрами.
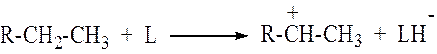
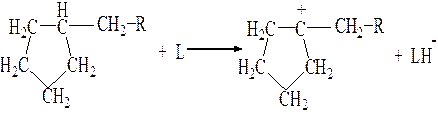
Образование карбениевых ионов из насыщенных углеводородов возможно и следующим образом:

Следует отметить, что ионы карбения в свободном виде не существуют, а находятся на поверхности катализатора в связанном с ней электростатическими силами состоянии.
Свойства ионов карбения
а) ионы карбения обладают высокой реакционной способностью, являются промежуточными соединениями в реакциях каталитического крекинга, протекающих по цепному механизму.
б) ионы карбения способны оторвать гидрид ион (Н:) от нейтральной молекулы и превратиться в нейтральную молекулу.
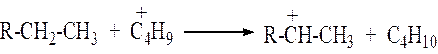
Легче отрывается гидрид-ион от третичного атома углерода, труднее – от первичного.
в) карбений-ион может отдать протон (Н+) олефину или катализатору и превратиться в нейтральную молекулу.
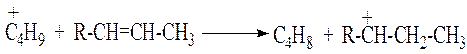
![]()
г) высокомолекулярные ионы карбения не стойкие соединения, легко распадающиеся по β-связи относительно заряженного атома углерода на олефин и ион карбения меньшей молекулярной массы.
![]()
Расщепление иона карбения на поверхности катализатора продолжается до тех пор, пока длина цепочки углеродных атомов не уменьшится настолько, что дальнейшее расщепление связи С—С в β- положении относительно заряженного атома углерода станет невозможным. Более энергетически выгодным является разрыв ионов карбения с образованием крупных осколков.
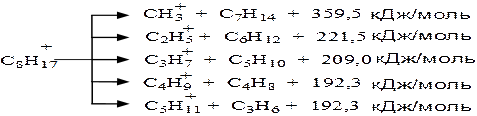
Таким образом, более выгодным является разрыв связей С–С с образованием симметричных фрагментов. Разрыв других связей С–С приводит к образованию малостойких карбокатионов СН3+ и С2Н5+. Общим правилом для алкилкарбениевых ионов является преимущественный симметричный разрыв молекулы. Алкилароматические карбокатионы распадаются с отрывом всей алкильной группы с образованием ароматического углеводорода и алифатического карбений иона.
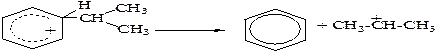
д) наиболее стабильными являются третичные ионы карбения, у которых положительный заряд несет третичный углеродный атом, наименее стабильны первичные.
Первичные ионы карбения могут легко превращаться во вторичные и далее в третичные. Эти превращения протекают за счет гидридного или алкильного переносов.
Гидридный перенос заключается в перемещении гидрид-иона от соседнего атома углерода к углеродному атому, несущему положительный заряд.
![]()
Алкильный перенос заключается в перемещении алкильной группы от соседнего атома С к атому углерода, заряженному положительно.
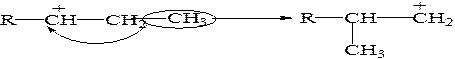
Далее образовавшийся вторичный карбокатион за счет гидридного переноса преобразуется в более стабильный третичный ион карбения.
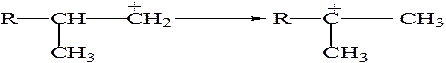
Изомеризация первичных ионов карбения во вторичные и затем в третичные энергетически выгодна и обуславливает повышенное содержание углеводородов разветвленного строения в продуктах крекинга.
Рассмотрим механизм каталитического крекинга различных углеводородов.
Парафиновые углеводороды
Первичным актом реакции при крекинге парафинов является образование карбокатиона, например, при взаимодействии с апротонными кислотными активными центрами.
![]()
Другие возможные пути образования карбений-ионов из алканов рассмотрены ранее.
Затем происходит разрыв связи С–С, находящейся в в-положении по отношению к атому углерода, несущему положительный заряд. При этом образуется б-олефин и ион карбения меньшей молекулярной массы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.