P1 = H + h1 ,
где Н – атмосферное давление. Удельный объем газа (объем, занимаемый единицей массы газа) в баллоне будет V1, а температура t1 = tкомн . Это состояние изобразится точкой А на графике, приведенном в таблице 1.
4). Открыть и очень быстро закрыть пробку q . При этом с воздухом в баллоне произойдут два следующие друг за другом процесса:
а). В момент открытия пробки происходит быстрое расширение воздуха, заключенного в баллоне, которое можно считать адиабатическим из-за его кратковременности. Давление при этом упадет до атмосферного и будет равно Р2 = Н объем возрастает до V2 , так как часть воздуха вышла, и на единицу массы теперь приходится больший объем. Температура становится ниже комнатной t2 < t1 , так как воздух адиабатически расширился. Это второе состояние изображается на графике, приведенном в таблице 1, точкой В.
б). После закрытия пробки q через 2 – 3 минуты воздух в баллоне в результате теплообмена снова нагревается до комнатной температуры tк . В процессе теплообмена происходит изохорическое нагревание воздуха, так как удельный объем V2 остается неизменным. При этом давление воздуха возрастает до
Р3 =Н + h2.
Разность уровней h2 ( после того, как она установится ) снова отмечают по шкале манометра. Это третье состояние газа изобразится точкой С (см. тот же график и таблицу).
Состояниям А и С соответствует одна и та же температура, поэтому на графике эти точки можно соединить изотермой.
Таблица трех состояний в процессе работы не заполняется, она нужна для вывода расчетной формулы.
Таблица 1
Три состояния воздуха при сжатии и графики соответствующих переходов
|
При каких условиях |
Состоя- ние |
Уд. объем |
Давле- ние |
Темпе- ратура |
|
|||
|
До откры- тия пробки |
А |
V1 |
H +h1 |
tк |
||||
|
В момент открытия пробки |
В |
V2 |
H |
t2 |
||||
|
После закрытия пробки |
С |
V2 |
H + h2 |
tк |
Таблица 2
Три состояния воздуха при расширении и графики соответствующих переходов
|
При каких условиях |
Состоя- ние |
Уд. объем |
Давле- ние |
Темпе- ратура |
|
|||
|
До откры- тия пробки |
А |
V1 |
H – h1 |
tк |
||||
|
В момент открытия пробки |
В |
V2 |
H |
tк |
||||
|
После закрытия пробки |
С |
V2 |
H – h2 |
tк |
Вывод расчетной формулы
Рассматривая переход воздуха из состояния А в состояние В как процесс адиабатический, применим к нему уравнение Пуассона
![]()
![]()
или 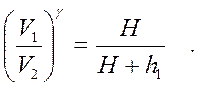 (1)
(1)
Переход от конечного состояния С к начальному состоянию А можно было бы произвести изотермически, так как температура в обоих состояниях одинаковая – tk..
Применим к этому переходу закон Бойля-Мариотта
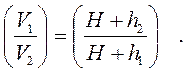 (2)
(2)
Возводя левую и правую части уравнения (2) в степень γ, получим
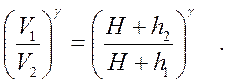 (3)
(3)
Левые части равенств (1) и (3) равны, следовательно, равны и правые
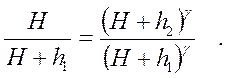 (4)
(4)
Логарифмируя (4), получим
![]()
откуда
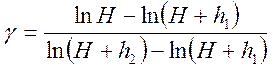
или 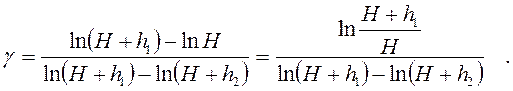
Вычитая и прибавляя в знаменателе последнего выражения ln H, получим
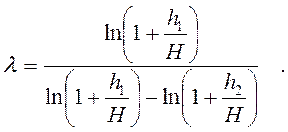
Из
теории рядов известно, что выражение ![]() может быть
представлено в виде
может быть
представлено в виде
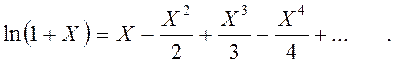
Если
Х мало, то ln ![]()
В нашем случае
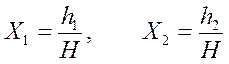 –
достаточно малы и
–
достаточно малы и
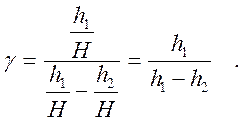
Формула (5) позволяет определить величину 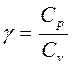 по двум показаниям манометра h1 и h2 .Опыт следует провести не менее пяти раз при различных
показаниях для случаев расширения и сжатия воздуха в баллоне. Результаты
измерений h1 и h2 занести в таблицу 3. Для каждой пары h1 и h2 по формуле (5) вычислить γ, полученные значения
занести в таблицу. Вычислить приближенное значение γ, абсолютную и
относительную погрешности. Окончательный результат записать в виде
по двум показаниям манометра h1 и h2 .Опыт следует провести не менее пяти раз при различных
показаниях для случаев расширения и сжатия воздуха в баллоне. Результаты
измерений h1 и h2 занести в таблицу 3. Для каждой пары h1 и h2 по формуле (5) вычислить γ, полученные значения
занести в таблицу. Вычислить приближенное значение γ, абсолютную и
относительную погрешности. Окончательный результат записать в виде
![]()
Таблица 3
Результаты измерений и вычислений
|
№ п/п |
h1 |
h2 |
|
|
|
Сжатие |
1 2 3 4 5 |
|||
|
Расширение |
1 2 3 4 5 |
Приближенное значение γпр
Абсолютная погрешность ∆γ
Контрольные вопросы
1. Что называется удельной и молярной теплоемкостями? Соотношение между ними. Единицы измерения.
2. Что такое Сv и что такое Ср ? Почему Ср > Сv ?
3. Какой процесс называется адиабатическим? Как практически можно осуществить адиабатический процесс?
4. Пользуясь первым началом термодинамики и уравнением Менделеева-Клапейрона, обосновать закон Пуассона для адиабатического процесса.
5. В системе координат P и V представьте адиабату и сопоставьте с изотермой. Почему адиабата идет более круто, чем изотерма?
6. Выведите расчетную формулу Клемана и Дезорма. Какие изопроцессы имели место в данной работе?
7. Проанализировать таблицы 1 и 2 для расширения и сжатия и выяснить физический смысл процессов.
1. Савельев И. В. Курс общей физики: Учебн. пособие для втузов: в 3 т. Т.1: Механика. Молекулярная физика. - 3-е изд., испр. - М.: Наука, 1986. – 432с.
2. Детлаф А. А. , Яворский Б. М. Курс физики: Учебн. пособие для втузов. - М.: Высшая школа, 1989. - 607 с. - предм. указ.: с. 588-603.
3. Зисман Г. А., Тодес О. М.. Курс общей физики для втузов: в 3 т. Т. 1: Механика, молекулярная физика, колебания и волны - 4-е изд., стереотип. - М.: Наука, 1974. - 340 с.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.