- по гидроксильной группе;
- по ароматическому ядру.
1. Фенолы, как и спирты, взаимодействуют со свободными щелочными и щелочноземельными металлами с образованием фенолятов, так же, как спирты образуют алкоголяты:
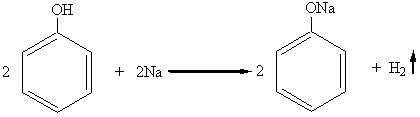
фенолят натрия
![]()
алкоголят
натрия
Проявляя кислотные свойства, фенолы взаимодействуют и с гидроксидами этих металлов:
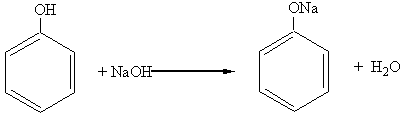
В последнюю реакцию алифатические спирты не вступают, демонстрируя очень слабые кислотные свойства.
2. Образование простых эфиров (идет через феноляты, а не через фенолы):
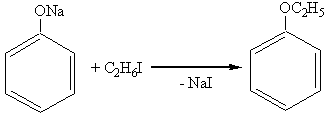
этилфениловый эфир (фенетол)
![]()
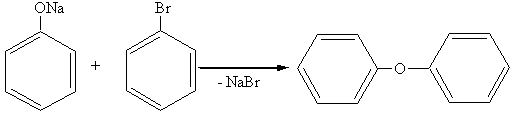
дифениловый эфир
3. Образование сложных эфиров (через галогенангидриды кислот):
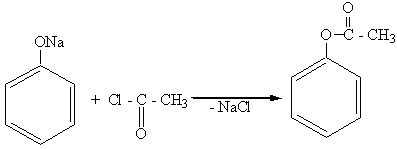
фенилуксусный эфир
1.Галогенирование.
При действии галогенов, даже бромной воды (Br2+H2O), три атома водорода в ядре очень легко замещаются, давая тригалогензамещенные фенолы:
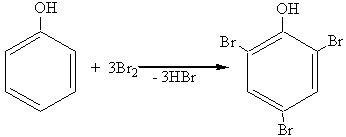
2,4,6-трибромфенол
2. Нитрование.
Фенолы легко нитруются. При действии даже очень разбавленной HNO3 получается смесь орто- и пара-нитрофенолов:
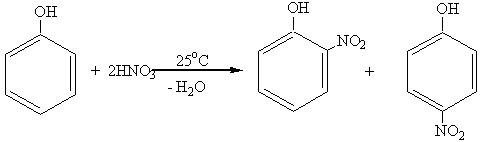
о-нитрофенол п-нитрофенол
NO2Å –сильная электрофильная частица. Она способствует в большей степени диссоциации атома водорода в гидроксильной группе. Введение второй NO2-группы требует уже кипячения с концентрированной HNO3:
|
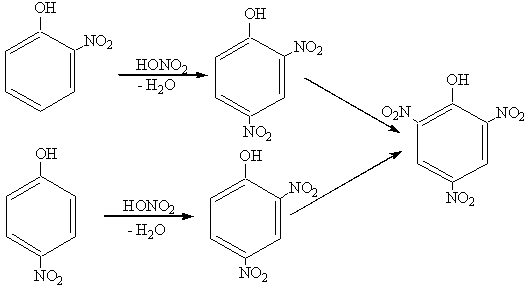
Для получения 2,4,6-тринитрофенола (пикриновой кислоты) нужно использовать смесь HNO3 и H2SO4 или 2-3 суток кипятить в концентрированной азотной кислоте.
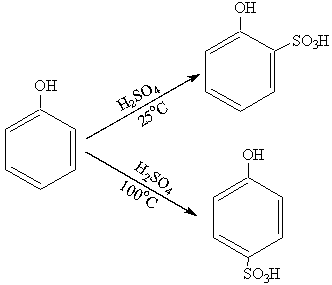
3. Сульфирование.
Фенолы легко сульфируются:
|
|
|
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.