МЕХАНИЗМ ВЗАИМОДЕЙСТВИЯ СУЛЬФГИДРИЛЬНЫХ СОБИРАТЕЛЕЙ С СУЛЬФИДАМИ. ГИПОТИЗА ШВЕДОВА.
Сульфгидрильные собиратели относятся к ионогенным анион-активным реагентам. В состав их солидофильной группы входит остаток сероводорода —SН (называемый по аналогии с гидроксилом — сульфгидрилом). Органические соединения, содержащие в своем составе сульфгидрильную группу, могут образовывать производные, где водород сульфгидрила замещен щелочным металлом (калием, натрием), легко отщепляющимся при диссоциации сульфгидрильного собирателя на ионы в его водных растворах. Возникающая при отщеплении щелочного металла свободная связь у серы, входящей в состав аниона реагента, и является ответственной за химическую фиксацию (закрепление) аниона собирателя на катионах металла в кристаллической решетке минерала.
Сульфгидрильные собиратели являются широко применяемыми и наиболее эффективными собирателями при флотации сульфидных и некоторых окисленных минералов цветных металлов. Высокое химическое сродство серы собирателя к тяжелым цветным металлам и соответствующие ему весьма низкие значения произведений растворимости соединений, образованных анионами сульфгидрильных собирателей и катионами тяжелых цветных металлов (медь, свинец, цинк, никель, висмут и др.) хорошо объясняют высокую устойчивость адсорбционных слоев этих собирателей на минералах цветных металлов и их высокую эффективность и избирательность действия при флотации.
Рассмотрим взаимодействие сульфгидрильных собирателей с поверхностью сульфидных минералов в соответствии с гипотезой Д.А.Шведова.
При взаимодействии реагентов с минералами имеет большое значение соотношение между растворимостями самого минерала и соединения, образующегося на его поверхности. Химические и хемосорбционные реакции направлены в сторону образования менее .растворимого при данном составе пульпы соединения. Растворимости объемных соединений известны или всегда поддаются определению. Однако для теории действия реагентов необходимо знать растворимость поверхностных соединений. По гипотезе Шведова, растворимость поверхностного соединения является промежуточной между растворимостью самого минерала и растворимостью объемной фазы того же состава, что и поверхностное соединение.
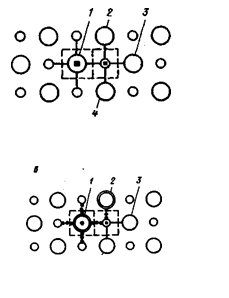
Как видно из рис.2.6 а, для растворения одной молекулы PbS , т.е. для перехода одного иона свинца и одного сульфидного иона с кристалла в раствор, необходимо преодолеть энергию девяти связей Pb–S , из которых семь лежат в плоскости рисунка (пересечения пунктирных линий связи со сплошными) и две, направленные перпендикулярно к этой плоскости, лежат за плоскостью рисунка (рис.2.6 а, черные квадраты). Если какой-либо находящийся на поверхности кристалла ион серы окислился до сульфатного, например, ион 1 (рис.2.6, б), а ионы серы, окружающие соседний ион свинца, т, е. ионы 2, 3, 4, 5х не подверглись окислению, то для растворения одной молекулы РЬS04 из поверхностного слоя необходимо преодолеть энергию четырех связей Pb–S и пяти связей Pb–SO4 (из них в плоскости рисунка три связи Рb-S и четыре Pb-SO4). При дальнейшем последовательном окислении ионов серы 2, 3, 4, 5 число преодолеваемых при растворении молекулы РЬS04 связей РЬ-S будет уменьшаться, а число связей Рb-S04 возрастать.
Ион 5 находится ниже плоскости чертежа и на рисунке не показан.
|
||||||
 |
||||||
|
||||||
![]() Рис. 2.6. Схема
изменения характера и числа связей, разрушающихся при растворении одной
молекулы поверхностного слоя галенита в зависимости от степе - ни окисления
ионов S2– до SO42–.
Ионы: о – Рb2+
; O – S2+; – SO42-
Рис. 2.6. Схема
изменения характера и числа связей, разрушающихся при растворении одной
молекулы поверхностного слоя галенита в зависимости от степе - ни окисления
ионов S2– до SO42–.
Ионы: о – Рb2+
; O – S2+; – SO42-
Таблица 2
Число связей РЬ-S и Pb-S04 разрушаемых при растворении одной молекулы PbS04 из поверхностного слоя сульфата свинца, находящегося на кристалле галенита (рис. 2.6)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.