Таким образом, диффузия электролита в растворе возникает как результат действия двух градиентов: градиента его концентрации и градиента поля, связанного с диффузионным потенциалом. На этом основании можно написать уравнения для скорости движения положительных ионов
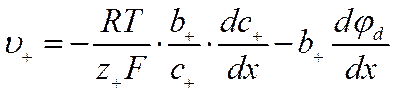
![]()
и для скорости движения отрицательных ионов
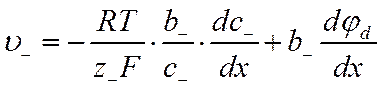
![]()
или
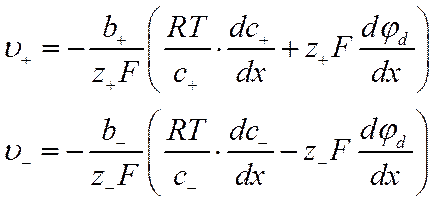
![]()
![]()
где djd/dx— градиент поля, соответствующий диффузионному потенциалу jd. При стационарном процессе диффузии скорости катионов и анионов равны u+ = u_, отсюда, предполагая равенство зарядов z+= z_= z и концентраций ионов c+= c_= c , получим
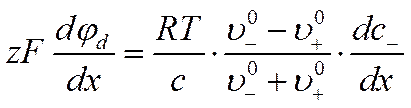
![]()
Так как u+ = u_, значение zFdjd/dx можно подставить в любое из уравнений для скорости движения ионов, например в уравнение (VI-17), и получить выражение для скорости движения электролита в целом
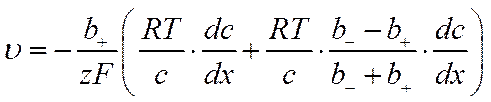
![]()
или
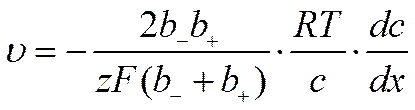
![]()
Число диффундирующих молей равно
![]()
![]()
И, следовательно,
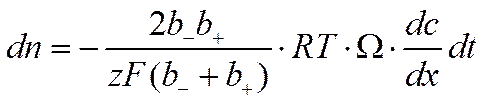
![]()
где
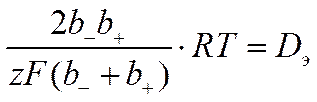
![]()
представляет собой коэффициент диффузии электролита.
Сопоставив уравнение для коэффициента диффузии электролита Dэ с полученными ранее формулами для коэффициентов диффузии Положительных D+ и отрицательных D_ ионов, можно выразить коэффициент диффузии электролита через коэффициенты диффузии его ионов. Для бинарных электролитов
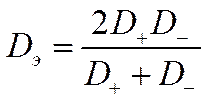
или для любого типа электролита
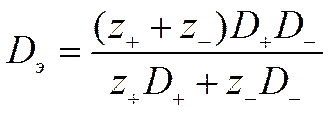
![]()
При практических расчетах коэффициента диффузии i-гo сорта ионов Di можно использовать следующие формулы:
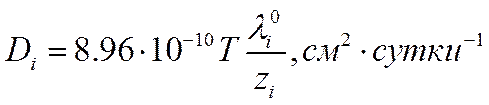
![]()
или
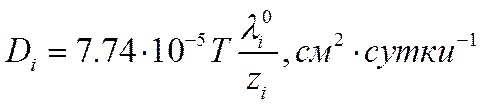
Некоторые значения коэффициентов диффузии отдельных ионов при 25° С, вычисленные по уравнению (VI-27), приведены в табл. 29.
Таблица 29
Коэффициенты диффузии отдельных ионов
|
Ион |
|
Ион |
|
|
|
9.34 |
|
5.23 |
|
|
1.04 |
|
2.03 |
|
|
1.35 |
|
1.09 |
|
|
1.98 |
|
1.08 |
|
|
0.98 |
|
1.07 |
|
|
0.72 |
||
|
|
0.69 |
||
|
|
0.72 |
Скорость диффузии 1-1 валентного электролита удобно вычислять по формуле
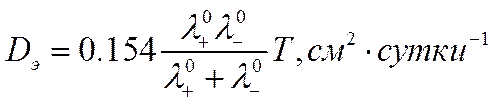
![]()
полученной из уравнения (VI-24) при подстановке в него численных значений постоянных величин и использовании суток как единицы времени.
Таблица 30
Коэффициенты диффузии 1-1 валентных электролитов при 18° С
|
Электролит |
|
|
|
|
1.000 |
0.949 |
|
|
1.170 |
1.173 |
|
|
1.466 |
1.460 |
|
|
1.903 |
2.109 |
|
|
2.324 |
2.431 |
|
|
0.930 |
1.368 |
В табл. 30 приводятся коэффициенты диффузии 1-1 валентных электролитов, рассчитанные по уравнению (VI-29) и найденные опытным путем. При проведении вычислений предполагалось, что степень диссоциации электролитов равна единице. Сходимость рассчитанных и опытных величин достаточно хорошая; исключение составляет уксусная кислота, что объясняется малой степенью ее диссоциации.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.