Электропроводность электролитов.
Класс веществ, называемых электролитами, обладают способностью при растворении в соответствующих растворителях, например в воде распадаться на отдельные заряженные частицы. Распад электролитов на ионы при растворении называется процессом электролитической диссоциации. Распад молекул на элементарные частицы, например молекул растворенной в воде поваренной соли, происходит уже до всякого действия электрического тока в самой жидкости благодаря находящимся в ней разнородным элементарным частицам. Число ионов, образовавшихся в результате диссоциации одной молекулы электролита, так же, как величина и знак заряда zэтих, ионов, зависят от его природы. Различают следующие типы электролитов. Бинарные электролиты, распадающиеся на два иона. Если оба иона одновалентны, как, например, при диссоциации хлорида натрия NaCl, то такой электролит называют одно-одновалентным. Электролиты при растворении распадаются на ионы не полностью. Только определенная часть растворенных молекул присутствует в виде ионов. Доля молекул, распавшихся в состоянии равновесия на ионы, отвечает степени электролитической диссоциации и обозначается через a. Степень электролитической диссоциации равна отношению числа молекул п, распавшихся на ионы, к общему числу растворенных молекул N (ионизированных п и неионизировапных пaионов )
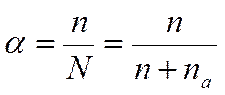
Степень электролитической диссоциации вещества, растворенного в данном растворителе, зависит (при постоянной температуре) от природы этого вещества и от его концентрации. Если вещество не диссоциирует при растворении (п = 0, па = N, а = 0), то оно не будет электролитом. Если aблизка к единице, то n~ N и соединение является сильным электролитом. Для многих химических соединений 0 < а << 1, а следовательно, п << N, и они будут слабыми электролитами.
Электролиты — это проводники II рода; в них электрический ток переносится ионами, поэтому электропроводность электролитов — функция зарядов ионов и скорости их движения. Электропроводность электролита выражают или как удельную электропроводность k, или как эквивалентную (молекулярную) электропроводность λ. Удельная электропроводность отвечает электрической проводимости слоя электролита, находящегося между двумя противоположными гранями куба с ребром, равным 1 см.
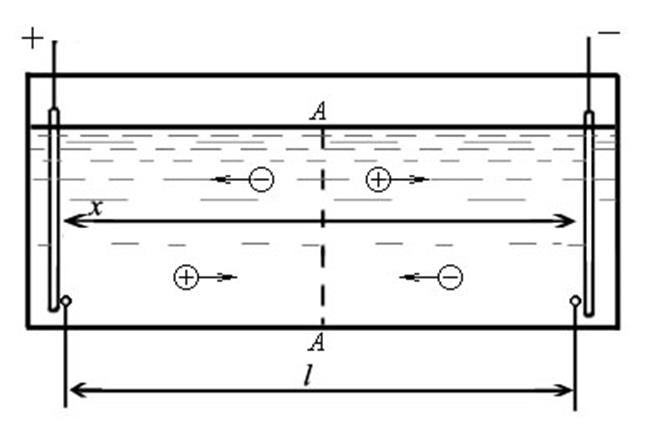
Рис. 8. Схема прохождения тока через растворы электролитов.
Она представляет собой величину, обратную удельному сопротивлению раствора ρ
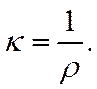
Эквивалентная (молекулярная) электропроводность определяется как проводимость слоя электролита толщиной 1 см, помещенного между одинаковыми электродами такой площади, чтобы объем электролита, заключенный между ними, содержал один грамм-эквивалент (одну грамм-молекулу) растворенного вещества. Между эквивалентной и удельной электропроводностью существуют следующие соотношения:
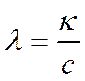 или
или ![]()
![]()
где с — концентрация электролита, г-экв/мл (или моль/мл); V — объем электролита, мл, содержащий при данной концентрации 1 г·экв или 1 моль растворенного вещества.
Предположим, что между двумя электродами (рис. 8) находится раствор электролита с площадью сечения, равной Ω. Пусть расстояние между двумя точками электролита в непосредственной близости от поверхности электродов будет l, а падение потенциала на этой длине l равно Δj. Тогда в растворе электролита должен существовать градиент поля j '
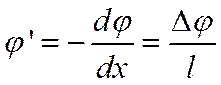
![]()
Если заряд i-го иона равен qi , то на него будет действовать электрическая сила fЭ i
![]()
![]()
Под действием этой силы ион начинает двигаться в направлении, параллельном электрическому полю с некоторой скоростью υi. Так как движение происходит в среде с конечной вязкостью, то неизбежно должна возникнуть сила трения fтр i
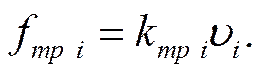
![]()
где kтр i — коэффициент трения. Под одновременным действием обеих сил (до тех пор, пока они не будут взаимно скомпенсированы) ион должен двигаться с некоторым ускорением аi, зависящим от его массы mi
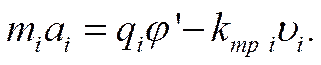
![]()
Учитывая, что
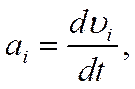 или
или 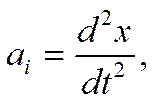
![]()
где t — время, получим после элементарных преобразований
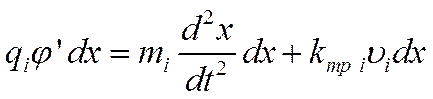
![]()
или
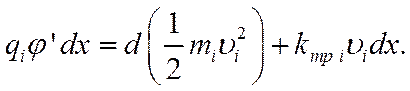
![]()
Таким образом, электрическая сила расходуется, во-первых, на то, чтобы сообщить иону некоторую кинетическую энергию движения в направлении поля d (1/2 miυi2) , и, во-вторых, на преодоление трения kтр iυi dx.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.