Из (IV-5) после подстановки в него значения аi из (IV-6) и последующего интегрирования можно найти уравнение движения иона в электрическом поле
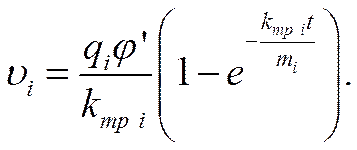
![]()
Так как коэффициент внутреннего трения по абсолютной величине много больше массы иона (kтр i >> mi), то через короткий промежуток времени τ величина еxp(-kтр iτ/ mi) будет очень малой по сравнению с единицей и ею можно пренебречь. Ион будет двигаться с равномерной скоростью
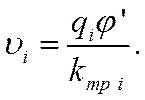
![]()
Подставив в уравнение (IV-10) вместо qi произведение z+e для положительных и z_e для отрицательных ионов, получим выражение скорости движения катионов υ+и анионов υ_
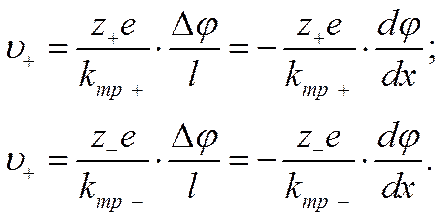
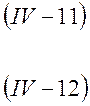
При 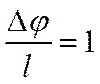
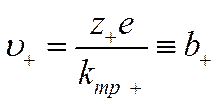 и
и 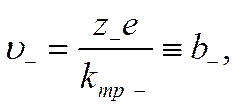
![]()
![]()
где b+ и b_— скорости движения ионов в данной среде при градиенте поля, равном единице. Они называются абсолютными скоростями движения ионов, или подвижностями.
Расхождения между опытом и классической теорией электропроводности вызываются тем, что в ней не учитываются силы взаимодействия между частицами раствора, прежде всего между ионами электролита друг с другом, а также и между ионами электролита и молекулами растворителя.
Диффузия в электролитах.
Диффузия возникает в результате неоднородности состава раствора, т. е. в том случае, когда отдельные участки раствора содержат различные вещества или одни и те же вещества, но в различной концентрации. Количественно процессы диффузии можно выразить при помощи законов Фика.
Пусть имеется труба сечением Ω, наполненная раствором какого-либо вещества (рис. 17), причем концентрация его убывает по направлению оси х.
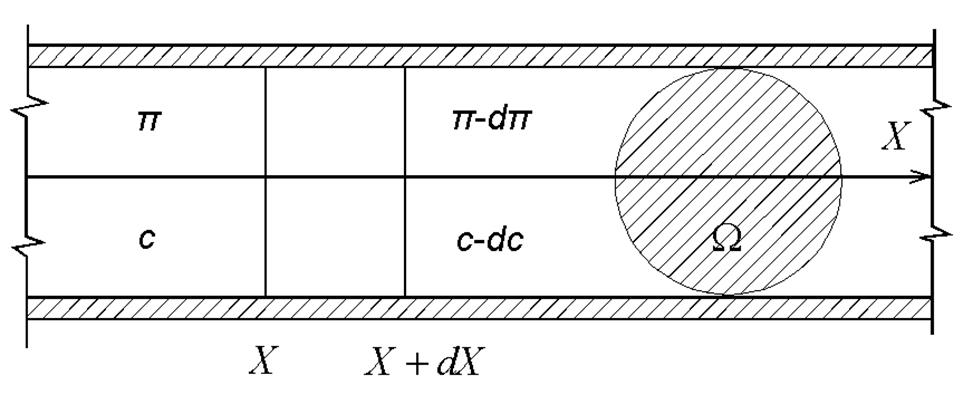
Рис. 17. Схема процесса диффузии
Тогда, если мысленно вырезать в этой трубе элементарный слой, заключенный между xи x+ dx(толщина его равна dx, а объем Ω dx), то слева от него концентрация и осмотическое давление будут иметь соответственно значения с и π, асправа — с - dс и π – dπ. В результате в направлении оси х на элементарный слой будет действовать избыточная сила Ω dπ, ана каждую частицу, находящуюся в слое Ω dx, избыточная сила, равная
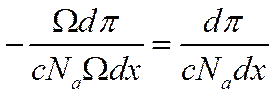
![]()
Под действием силы осмотического давления частицы (молекулы, ионы) должны двигаться по направлению оси xсо скоростью u, определяемой из уравнения
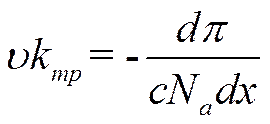
![]()
kтр — коэффициент внутреннего трения.
Предполагая, что компоненты раствора не взаимодействуют, и к раствору применимы законы идеальных газов и выражая dπчерез RTdс, можно переписать уравнение (VI-2) в виде
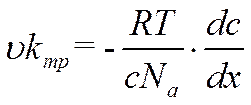
![]()
За время dtчерез сечение Ω пройдет число частиц dn
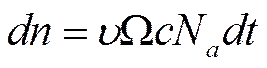
![]()
или после исключения u
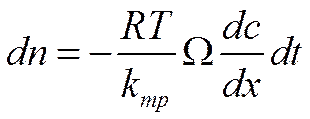
![]()
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.