Окислительно-восстановительными реакциями (ОВР) называются реакции, протекающие с изменением степени окисления некоторых элементов, входящих в состав реагирующих веществ.
Степень окисления характеризует состояние элемента в веществе, насыщенность его электронами. Формально степень окисления может быть положительной, нулевой и отрицательной. Она проставляется справа от элемента, вверху.
Положительная степень окисления равна числу электронов, смещенных от данного атома. Например: Н+1Сl, С+4О2, Н3Р+5О4.
Отрицательная степень окисления равна числу электронов, смещенных в сторону данного атома от атомов связанных с ним элементов. Например: НСl-1, H2S-2, N-3Н3.
При определении степени окисления по формуле необходимо помнить:
- степень окисления кислорода в соединениях равна -2. Исключения: OF2, где степень окисления кислорода равна +2; Н2О2 - степень окисления кислорода -1; O2F2 - степень окисления кислорода +1;
- степень окисления водорода в соединениях +1. Исключение составляют гидриды, где степень окисления -1; например, Na+H-.
- степень окисления простых веществ всегда равна 0;
- алгебраическая сумма всех степеней окисления элементов, входящих в электронейтральное соединение, равна 0.
Например,
H2+1S+604-2,
где 2·(+1) + (+6) + 4·(-2) = 0;
- подавляющее число элементов проявляет в соединениях переменную степень окисления. Например: H2S-2, S+2O, S+4О2, S+6O3.
В любой окислительно-восстановительной реакции должен быть окислитель и восстановитель.
Окислитель - элемент, принимающий электроны. Процесс присоединения электронов называется восстановлением, т.е. окислитель в ходе реакции восстанавливается, степень его окисления понижается.
Например:
S0 + 2ē ® S-2,
Fe+3 + 1ē ® Fe+2,
Mn+7 + 5ē ® Mn+2,
Cr+6 + 3ē ® Сг+3.
Сильными окислителями являются фтор и другие галогены в свободном состоянии, кислород, сера, а также вещества, содержащие элементы в высшей степени окисления: Sn+4O2, KMn+7O4, K2Cr2+6O7.
Восстановитель – элемент, отдающий электроны. Процесс отдачи электронов называется окислением, т.е. восстановитель в ходе реакции окисляется, степень его окисления повышается. Например:
Са0 - 2ē ® Са+2,
S-2 - 8ē ® S+6,
Sn+2 - 2ē ® Sn+4.
Сильными восстановителями являются водород, все металлы в свободном состоянии, а также вещества, содержащие элементы с отрицательной степенью окисления: Сl-, Br-, S-2.
Окислителями и восстановителями могут быть все элементы в промежуточной степени окисления в зависимости от реагентов и среды.
Следует помнить, что рассмотрение реакции окисления-восстановления как процесса отдачи и присоединения электронов не всегда отражает истинное положение вещей, так как в большинстве случаев происходит не перенос электронов, а только смещение электронного облака связи от одного атома или иона к другому. Поэтому правильнее говорить об изменении электронной плотности у восстановителя и окислителя и характера поляризации атомов.
Различают три типа окислительно-восстановительных реакций:
1. Межмолекулярные реакции. Протекают с изменением степени окисления атомов в различных молекулах, т.е. окислитель и восстановитель находятся в разных веществах. Например,
2KN+5O3 + С0 = 2КN+3О2 + С+4О2.
2. Внутримолекулярные реакции протекают с изменением степени окисления разных атомов в одной и той же молекуле. При этом атом с более положительной степенью окисления окисляет атом с меньшей степенью окисления. Например,
2Cu(N+5O3-2)2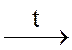 2CuO + O20 +
4N+4O2.
2CuO + O20 +
4N+4O2.
3. Реакции самоокисления-самовосстановления или диспропорционирования (дисмутации) протекают одновременно с увеличением и уменьшением степени окисления атомов одного и того же элемента. Например,
4Na2S+403 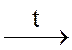 3Na2S+604
+ Na2S-2.
3Na2S+604
+ Na2S-2.
Существует два метода составления окислительно-восстановительных реакций: метод электронного баланса; электронно-ионный метод.
Оба метода основаны на законе сохранения заряда. При выполнении лабораторной работы используем метод электронного баланса.
Порядок выполнения действия следующий:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.