V = k · [A]a · [B]b,
где [А] и [В] - концентрация вещества А и В; a и b - их стехиометрические коэффициенты; k - коэффициент пропорциональности, называемый константой скорости. Сумма показателей степени в этом выражении называется порядком реакции N = a + b.
При повышении температуры скорость реакции увеличивается. В количественном отношении влияние температуры на скорость гомогенных химических реакций может быть выражено приближенно правилом Вант - Гоффа:
Повышение температуры на 10°С увеличивает скорость гомогенных химических реакции в 2-4 раза.
Наиболее общая зависимость скорости реакции от температуры выражается уравнением Аррениуса:
ln k = B – 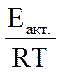 или k = k0
· e –Eакт./RT,
или k = k0
· e –Eакт./RT,
где Еакт. - энергия активации - та энергия, которой должны обладать молекулы в момент столкновения, чтобы быть способными к данному химическому взаимодействию.
Для гетерогенных процессов скорость реакции зависит от величины поверхности раздела между фазами, на которой происходит сама реакция, и пропорциональна площади поверхности соприкосновения реагирующих веществ.
Под химическим равновесием понимают состояние, когда скорости прямой и обратной реакции равны между собой. Для обратимой реакции
aA + dB D cC + dD
скорость прямой реакции Vпр. = k1 · [A]a · [B]b равна скорости обратной реакции Vобр. = k2 · [С]с · [D]d, т.е. Vпр. = Vобр.. Отсюда, k1 · [A]a · [B]b = k2 · [С]с · [D]d, а отношение констант скоростей прямой (k1) и обратной (k2) реакций называется константой равновесия К:
К = ![]() =
= 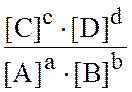 .
.
Константа равновесия зависит от температуры и природы реагирующих веществ и не зависит от их концентрации.
Переход системы из одного равновесного состояния в другое называется смещением химического равновесия. Оно подчиняется принципу Ле-Шателье:
Если изменить одно из условий, при которых система находится в состоянии химического равновесия (концентрацию, температуру, давление), то в системе протекают процессы, ослабляющие произведенное изменение.
2. Экспериментальная часть
Опыт № 1. Влияние концентрации на скорость реакции
Зависимость скорости реакции от концентрации исследуется на примере реакции между тиосульфатом натрия Na2S2O3 и серной кислотой H2SO4:
Na2S2O3 + H2SO4 ® Na2SO4 + H2S2O3
Образовавшаяся серноватистая кислота неустойчива и распадается по схеме:
Н2S2O3 ® H2SO3 + S¯
Сера в начале появляется в мелкодисперсном состоянии, ее можно обнаружить по появлению голубоватой опалесценции – явления рассеивания света на мелкодисперсных частицах.
Таблица 4.1
|
№ пробирки |
Кол-во капель раствора Na2S2O3 |
Кол-во капель дистил. воды |
Кол-во капель раствора H2SO4 |
Общее число капель в пробирке |
Концентрация С, условные ед. |
lnC, (условные ед.) |
Время течения реакции t, c |
Скорость реакции V = С/t, с-1 |
lnV, (c-1) |
Порядок реакции |
|
1 |
3 |
12 |
1 |
16 |
1 |
0 |
||||
|
2 |
6 |
9 |
1 |
16 |
2 |
0,69 |
||||
|
3 |
9 |
6 |
1 |
16 |
3 |
1,1 |
||||
|
4 |
12 |
3 |
1 |
16 |
4 |
1,39 |
||||
|
5 |
15 |
0 |
1 |
16 |
51 |
1,61 |
Предварительно проделайте качественный опыт. Для этого внесите в пробирку 5-10 капель 1н. раствора тиосульфата натрия и 3-5 капель 2н. раствора серной кислоты. Постарайтесь заметить появившуюся через некоторое время очень слабую опалесценцию, которая затем усиливается, переходя в явную муть.
Для проведения опыта заготовьте в пяти пробирках равные объемы тиосульфата натрия различной концентрации, добавив в четыре пробирки воду, как указано в табл. 4.1.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.