Количественно этот процесс характеризуется степенью диссоциации a:
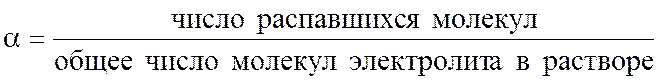 .
.
Величина a изменяется от нуля до единицы. Степень диссоциации зависит от природы электролита, его концентрации в растворе и температуры. По степени диссоциации в растворе все электролиты можно условно разделить на две группы:
- сильные электролиты: a » 1 и почти не зависит от концентрации раствора. К ним относятся водные растворы большинства солей, щелочи и растворы кислот HNO3, HCl и др.;
- слабые электролиты: a < 1 и уменьшается с ростом концентрации. К ним относятся вода, ряд кислот, основания p-, d- и f-элементов.
Между этими двумя группами нет четкой границы. Одно и то же вещество, в зависимости от природы растворителя, может быть как сильным, так и слабым электролитом.
Процесс диссоциации одноосновной кислоты НСl можно выразить уравнением:
НСl D Н+ + Сl-.
Многоосновные кислоты, основания металлов, имеющих степень окисления +2 и выше, диссоциируют ступенчато. Например, диссоциация ортофосфорной кислоты происходит в три ступени:
Н3РО4 D Н2РО4- + Н+ - 1 ступень,
Н2РО4- D НРО42- + Н+ - 2 ступень,
НРО42- D РО43- + Н+ - 3 ступень.
Суммарный процесс диссоциации ортофосфорной кислоты можно записать в виде уравнения:
Н3РО4 D 3Н+ + РО43-.
Как всякая химическая реакция, диссоциация является обратимым процессом, который при достижении равновесия можно охарактеризовать константой диссоциации:
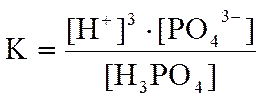 .
.
В случае ступенчатой диссоциации каждая ступень имеет свою константу диссоциации. Например, для раствора ортофосфорной кислоты при температуре 25°С
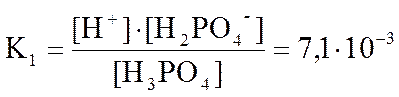 ;
;
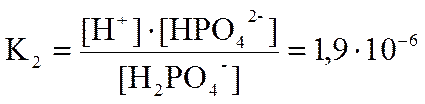 ;
;
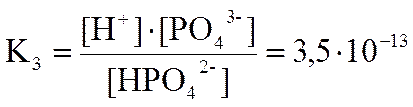 .
.
Константа диссоциации убывает с ростом номера ступени диссоциации потому, что с повышением отрицательного заряда кислотного остатка возрастает энергия, необходимая для отрыва от него положительно заряженного иона водорода. Константа диссоциации зависит от температуры и природы электролита, но, в отличие от степени диссоциации, не зависит от концентрации.
Ионное произведение воды. Химически чистая вода является слабым электролитом. Условно реакция диссоциации молекул воды записывается так:
Н2О D Н+ + ОН-,
При температуре 22 ºС концентрация ионов мала:
[Н+] = [ОН-] =10-7 моль/л,
поэтому концентрацию недиссоциированных молекул воды можно считать постоянной величиной: [Н2О] - const. Тогда постоянным будет и произведение ионов - ионное произведение воды Пр:
Пр = [H+] · [OH-] = 10-14.
Водородный показатель. Соотношением концентраций ионов водорода и гидроксида характеризуется основность и кислотность раствора. Чистая вода, в которой концентрации ионов [Н+] и [OH-] равны, считается нейтральной средой. В кислых растворах [H+] > 10-7 моль/л, a [OH-] < 10-7 моль/л, в основных растворах [Н+] < 10-7 моль/л, а [OH-] > 10-7 моль/л. Для удобства основность или кислотность водных сред принято количественно характеризовать водородным показателем рН - отрицательным десятичным логарифмом концентрации ионов водорода в растворе:
рH = -lg[H+].
Очевидно, что для чистой воды рН = 7, для кислых сред рН < 7, а для основных рН > 7.
Задача: Вычислить рН 0,01М раствора соляной кислоты.
Решение.
[Н+] = Снcl = 0,01 = 10-2 моль/л,
pН = -lg[H+] = -lg 10-2 = 2,
рН = 2.
Гидролиз солей. Гидролизом называют процесс разложения водой веществ, составные части которых в этом процессе соединяются с составными частями воды. При гидролизе солей продукты их диссоциации (анионы An- и катионы Kt+) взаимодействуют с продуктами диссоциации воды с образованием слабого электролита - основания или кислоты по схеме
An- + Н2О = НАn + ОН-,
Кt+ + Н2O = КtOН + H+.
Гидролизу подвергаются соли, образованные либо сильной кислотой и слабым основанием, либо сильным основанием и слабой кислотой, либо слабым основанием и слабой кислотой.
Как всякий химический процесс, гидролиз можно представить в виде молекулярных и ионных уравнений.
Для примера рассмотрим гидролиз СuСl2 - соли, образованной сильной кислотой HCl и слабым многокислотным основанием Cu(OH)2. В обычных условиях гидролиз этой соли идет ступенчато. Первая ступень гидролиза по катиону представляется молекулярным уравнением:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.