Все вещества в природе делятся на простые и сложные.
Простые вещества состоят из атомов одного элемента. Например: S, O2, Cl2, Na, P. Простые вещества разделяют на металлы и неметаллы. Это деление основано на различиях в физических свойствах простых веществ.
Металлы отличаются характерным металлическим блеском, ковкостью, могут прокатываться в листы или вытягиваться в проволоку, обладают хорошей тепло- и электропроводностью. При комнатной температуре все металлы (кроме ртути) находятся в твердом состоянии. В Периодической системе элементов Д.И. Менделеева (приложение 9) металлами являются все s-, d-, f-элементы и половина p-элементов, расположенных слева под диагональю, проходящей от бора к астату.
Неметаллы в твердом состоянии не обладают характерным для металлов блеском, хрупки, очень плохо проводят тепло и электричество. Некоторые из них при обычных условиях газообразны. В Периодической системе элементов Д.И. Менделеева неметаллами являются p-элементы, которые находятся справа над диагональю, проходящей от бора к астату.
В состав сложных веществ входят два или более элемента. Например: H2O, HCl, H3PO4, Na2CO3.
Сложные вещества делятся на органические и неорганические. Органическими принято называть соединения углерода. Например: СH3COOH - уксусная кислота, C2H5OH - этиловый спирт.
Простейшие соединения углерода (CO, CO2, H2CO3 и карбонаты, HCN и цианиды, карбиды и некоторые другие) обычно рассматривают в курсе неорганической химии. Все остальные вещества называются неорганическими (иногда - минеральными). Неорганические вещества делятся на пять главных классов: оксиды, кислоты, основания, амфотерные гидроксиды и соли. Кислородсодержащие кислоты, основания и амфотерные гидроксиды по своей природе можно объединить в самостоятельный класс гидроксидов.
Оксидами называются все соединения, состоящие из кислорода и какого-нибудь элемента. Если элемент образует несколько оксидов, то по числу атомов кислорода, приходящихся на атом элемента, оксиды называются так: CO - монооксид углерода, CO2 - диоксид углерода и т.д.
Большинство оксидов непосредственно или косвенным путем образуют с водой соединения, носящие название гидратов оксидов, или гидроксидов. Например:
CaO + H2O = Ca(OH)2,
SO2 + H2O = H2SO3.
При нагревании гидроксиды, кроме гидроксидов щелочных и щелочноземельных металлов, разлагаются на оксид и воду:
Ca(OH)2 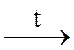 СaO + H2O,
СaO + H2O,
H2SO3
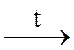 SO2 + H2O.
SO2 + H2O.
Гидроксиды, в зависимости от их свойств, относят или к классу кислот, или к классу оснований. Кроме того, существуют гидроксиды, обладающие одновременно свойствами и кислот, и оснований. Они называются амфотерными гидроксидами. В соответствии с этим, оксиды, образующие гидроксиды, делятся на три группы: кислотные, оснόвные и амфотерные.
Кислотные оксиды - оксиды, гидраты которых являются кислотами. Это главным образом оксиды неметаллов (SO3, NO2), хотя некоторые высшие оксиды металлов тоже являются кислотными (CrO3, Mn2O7). Многие кислотные оксиды непосредственно соединяются с водой, образуя кислоты:
SO3 + H2O ® H2SO4.
Гидроксиды других кислотных оксидов получают косвенным путем.
Кислотные оксиды иногда называют ангидридами соответствующих кислот (например, P2O5 - ангидрид фосфорной кислоты, или просто фосфорный ангидрид).
Главный отличительный признак кислотных оксидов - их способность взаимодействовать с основаниями с образованием солей. Например,
CO2 + 2NaOH ® Na2CO3 + H2O.
Кислоты, как правило, не взаимодействуют с кислотными оксидами.
Оснόвные оксиды - оксиды, гидраты которых являются основаниями. Основные оксиды образуются исключительно металлами. Только оксиды щелочных и щелочноземельных металлов непосредственно соединяются с водой, образуя растворимые в воде основания - щелочи. Большинство же основных оксидов не взаимодействуют с водой; соответствующие им основания получаются косвенным путем и нерастворимы в воде (Приложение 3). Все основные оксиды взаимодействуют с кислотами с образованием солей, но не взаимодействуют с основаниями. Например,
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.