В пробирку № l добавьте 1 каплю 2н. раствора серной кислоты и встряхните ее. В момент прибавления кислоты пустите в ход секундомер, по которому определите время от начала реакции до появления слабой опалесценции. Аналогично повторите опыт с заготовленными растворами тиосульфата натрия.
Данные опыта занесите в табл. 4.1. Приняв концентрацию тиосульфата в первой пробирке за единицу, постройте график, откладывая на оси абсцисс концентрации, а на оси ординат - относительную скорость реакции, т.е. величины, обратные времени.
Каким должен быть график при идеальном выполнении закона действия масс? Сделайте вывод о зависимости скорости реакции от концентрации реагирующих веществ. Как согласуются Ваши наблюдения с законом действия масс?
Определение порядка реакции по одному из компонентов
Расчетное задание для самостоятельной работы
Полученные экспериментальные данные позволяют определить порядок реакции по одному из компонентов - Na2S2O3, поскольку в опыте изменяли концентрацию только одного из компонентов.
Записанное ранее для реакции aA + bB D cC + dD выражение закона действующих масс
V = k · [A]a · [B]b,
содержит произведение концентрации исходных веществ в степенях a и b. Величины a и bопределяют порядок реакции по реагенту А и В соответственно, a иx сумма дает общий порядок реакции N. Обычно пишут, что a и b равны стехиометрическим коэффициентам, стоящим перед этими компонентами в уравнении реакции. Однако это верно только для тех случаев, когда уравнение химической реакции строго описывает механизм протекания реакции. В этом случае порядок реакции является целым числом и совпадает по величине с молекулярностью реакции - числом молекул, участвующих в одном химическом акте взаимодействия. В подавляющем большинстве случаев суммарная реакция, аналогичная реакции
Na2S2O3 + H2SO4 ® Na2SO4 + H2S2O3 (4.1)
не соответствует механизму протекания реакции и поэтому порядок реакции нельзя определить по стехиометрическим коэффициентам такой суммарной реакции, и он, как правило, не является целым числом.
В нашем опыте изменяли концентрацию только одного компонента - тиосульфата натрия, поэтому в выражении для скорости этой реакции
V = k · [Na2S2О3]a · [H2SO4]b
концентрацию серной кислоты можно считать постоянной и ввести в константу скорости реакции. Окончательно имеем:
V = k1 · [Na2S2О3]a ,
где a - порядок реакции по тиосульфату натрия.
В этой формуле k1 - новое значение константы скорости реакции:
k1 = k · [H2SO4]b.
В общем виде это выражение можно записать так:
V = k · Ca
Это степенное выражение после логарифмирования имеет вид
ln V = In k + a lnC
и графически в логарифмических координатах InV = f(InC) может быть представлено прямой (сравните с известным из аналитической геометрии уравнением прямой у = m + nх, где у = lnV; m = ln k: n = a; x = lnC). Значит, на графике (рис. 4.1) экспериментальные данные должны лежать на прямой, угловой коэффициент которой будет равен порядку реакции a.
Показанные на рис. 4.1 отклонения экспериментальных данных от линейной зависимости связаны с неизбежными погрешностями при приготовлении растворов и определении времени протекания реакции. Определение углового коэффициента выполняется по двум произвольным точкам на прямой и соответствующим им значениям ln С и ln V по схеме:
|
ln V2 = ln k + a ln C2 |
|
|
ln V1 = ln k + a ln C1 |
|
|
ln V2 - ln V1= a (ln C2 - ln C1) |
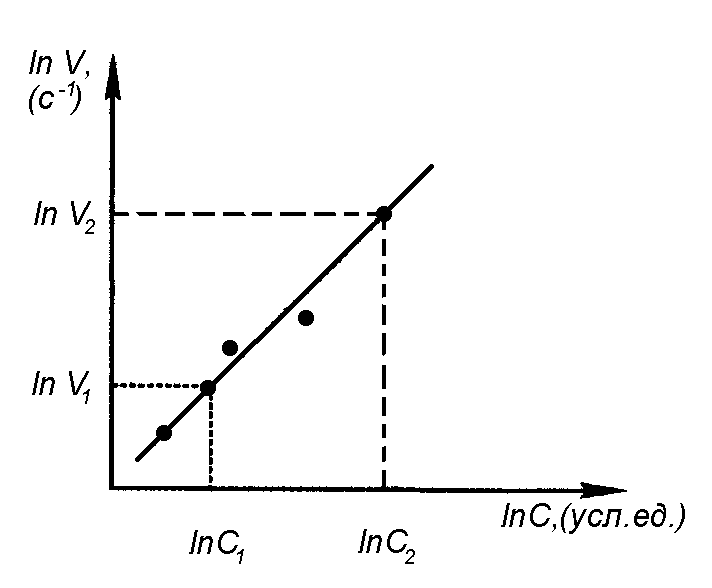
Рис. 4.1. Зависимость скорости гомогенной реакции от концентрации
в логарифмических координатах
Определите порядок реакции a по тиосульфату натрия и по его значению сделайте вывод, описывают ли уравнении реакции (4.1) механизм протекания процесса.
Опыт №2. Влияние температуры на скорость химической реакции
Таблица 4.2
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.