|
№ наблюдения |
Температура раствора Т, К |
Время течения реакции t, с |
Скорость реакции V = с/t, с-1 |
InV, (с-1) |
Обратная температуpa l/Т, К-1 |
Энергия активации реакции Eакт., кДж/моль |
|
1 |
||||||
|
2 |
||||||
|
3 |
||||||
|
4 |
||||||
|
5 |
Опыт проводится с постоянной концентрацией Nа2S2Оз при пяти различных значениях температуры.
При комнатной температуре в пробирку внесите 10 капель 1н. раствора тиосульфата натрия, добавьте в нее 1 каплю 2н. раствора серной кислоты. По секундомеру определите время от начала реакции до появления слабой опалесценции. Затем проделайте опыт при температуре на 10 °С выше комнатной. Для этого залейте в термостат воду нужной температуры (tкомн. + 10 °С). В одну из пробирок термостата внесите 7-8 капель 2н. раствора серной кислоты, а в другую - 10 капель 1н. раствора тиосульфата натрия. Через 2-3 минуты добавьте 1 каплю 2н. раствора серной кислоты из пробирки, находящейся в термостате, в пробирку с раствором тиосульфата натрия. По секундомеру отсчитайте время появления голубоватой опалесценции.
Повторите опыт 4 раза, увеличивая температуру воды в термостате каждый раз на 10 °С. Данные наблюдения занесите в табл. 4.2.
Представьте полученные результаты графически в координатах V - скорость реакции, Т - температура.
Сделайте вывод о характере зависимости скорости химической реакции от температуры.
Определение энергии активации реакции
По экспериментальным данным о влиянии температуры на скорость химической реакции можно определить энергию активации реакции. Из общего выражения
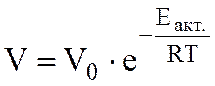
следует, что энергия активации Еакт экспоненциально влияет на скорость и не зависит от температуры реакции. Логарифмирование позволяет получить это выражение в виде прямой в полулогарифмических координатах ln V = f(1/T):
ln V = ln V0 - 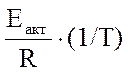 ,
,
где
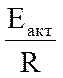 - угловой коэффициент этой прямой.
- угловой коэффициент этой прямой.
На рис. 4.2 показана схема построения линейной зависимости lnV от обратной температуры 1/Т по экспериментальным данным из табл. 4.2.
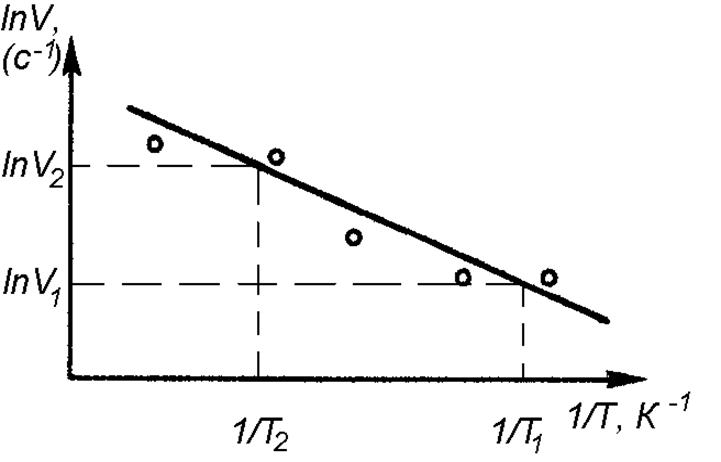
Рис. 4.2. Температурная зависимость скорости реакции
взаимодействия тиосульфата натрия с серной кислотой
в полулогарифмических координатах
Расчет энергии активации выполняют как определение углового коэффициента прямой, построенной по экспериментальным результатам (аналогично опыту № 1), по двум произвольным точкам, лежащим на прямой.
В расчетах значение универсальной газовой постоянной необходимо принять равной 8,3 Дж/моль·к:
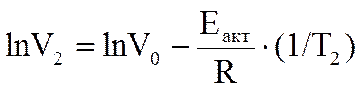
-
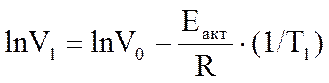
______________________
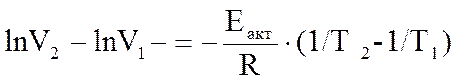
Откуда:
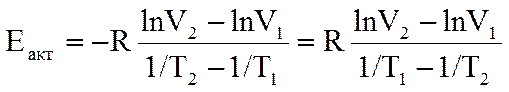
По величине энергии активации сделайте вывод о степени влияния температуры на скорость исследованной реакции и укажите, чем Еакт отличается от DН реакции.
Опыт №3. Влияние катализатора на скорость химической реакции
Налейте в две пробирки по 5 капель 3% раствора пероксида водорода Н2О2, в одну внесите на кончике микрошпателя несколько крупинок диоксида марганца МnО2. Другую пробирку оставьте для сравнения. Объясните наблюдаемое явление. Напишите уравнение реакции разложения пероксида водорода.
Опыт №4. Скорость реакции в гетерогенных процессах
Поместите в одну пробирку маленький кусочек мрамора, а в другую – примерно такое же количество измельченного мрамора. В обе пробирки одновременно добавьте по одной капле 0,1н раствора соляной кислоты. Наблюдайте за скоростью реакции в обеих пробирках. Напишите уравнение реакции. Какой фактор в данном случае влияет на увеличение скорости реакции?
Влияние концентрации реагирующих веществ на химическое равновесие исследуйте на примере реакции
FeCl3 + 3KCNS D Fe(CNS)3 + 3KCl.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.