Способы защиты металлов от коррозии
Цель защитных мер - максимально затормозить скорость коррозионного процесса. Этого обычно достигают воздействием либо на металл, либо на среду, либо на поверхность раздела металл – среда (рис. 7.2.)
Радикальным методом защиты от коррозии путем воздействия на металл является замена самого металла на его оксид или полимер, либо создание коррозионно-стойких сплавов. К средствам воздействия на металл относится электрохимическая защита, когда защищаемый металл подвергается катодной поляризации либо от внешнего источника (катодная защита), либо созданием электрического контакта с более активным металлом (протекторная защита).
Воздействовать на среду можно путем удаления агрессивных агентов (окислителей). Если этого сделать нельзя, то для замедления процесса в жидкой и газовой среде следует применять специальные вещества - ингибиторы коррозии. Наиболее широко используются для защиты от коррозии средства воздействия на поверхность раздела металл - окружающая среда. Как правило, это защитные покрытия. Нанесение защитных покрытий механически изолирует поверхность металла от окружающей среды, а также изменяет ее электрохимические свойства.
Пассивирование металлов осуществляется путем образования на их поверхности пассивирующих пленок из оксидов или труднорастворимых солей.
При оксидировании происходит уплотнение защитной оксидной пленки. Оксидирование осуществляется химическим и электрохимическим способами.
|
|
Изменение свойств коррозионной среды |
Применение коррозионно-стойких сплавов |
Защитные покрытия |
Замена металлов полимерами |
|





|
Смазки лаки, краски |
Эмалирование |
Химические защитные пленки |
Адсорбционные защитные пленки |
Полимерные покрытия |
Металлические покрытия |
Протекторная защита |
![]()




|
Оксидирование |
Фосфатирование |
Пассивирование |
Катодные |
Анодные |
Катодная и анодная |
Металлические покрытия из металлов, устойчивых к коррозии (Zn, Sn, Ni, Ag, Cr), наносят путем электролиза (гальваностегии).
По характеру защитного действия различают анодные и катодные металлические покрытия. Анодными называются такие покрытия, в которых покрывающий металл имеет более отрицательный потенциал. Например, анодным является цинковое покрытие на железо. При нарушении целостности покрытия возникают гальванопары, в которых роль анода будет выполнять цинк.
Катодными являются такие покрытия, в которых покрывающий металл имеет более положительный электродный потенциал (Sn на Fe).
2. Экспериментальная часть
В пробирку внесите 8-10 капель 1н. раствора серной кислоты и поместите туда гранулу цинка. Наблюдайте медленное выделение водорода. Введите в раствор медную проволоку, не доводя ее до соприкосновения с цинком. Наблюдается ли выделение водорода на меди? Погрузите медную проводку глубже так, чтобы она контактировала с цинком. Объясните выделение водорода на меди в этом случае. Составьте схему действия образовавшейся гальванопары. Как повлиял на коррозию цинка контакт с медью?
Опыт № 2. Коррозия в результате различного доступа кислорода
(аэрационная коррозия)
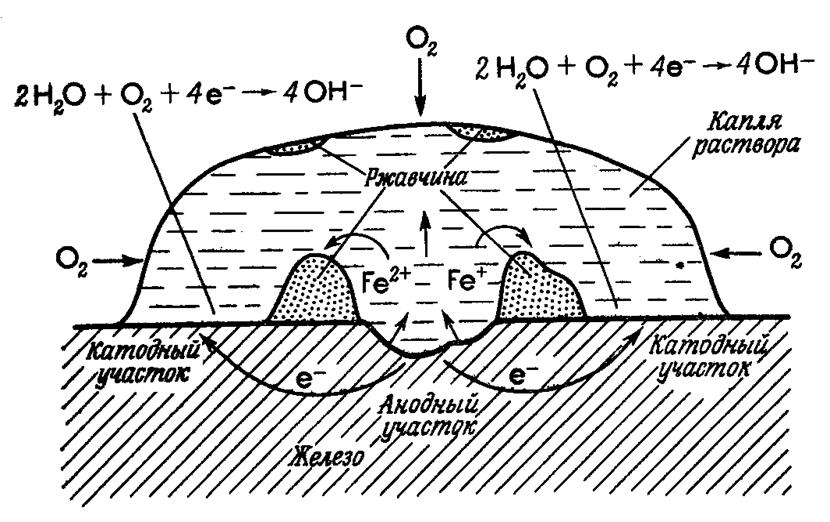
Рис. 7.3. Коррозия железа под каплей раствора хлорида натрия
Очистите стальную пластинку наждачной бумагой, промойте и вытрите фильтровальной бумагой. На чистую поверхность нанесите каплю специального реактива, состоящего из 3 % раствора хлорида натрия, к которому добавлен фенолфталеин и гексацианоферрат(III) калия К3[Fe(CN)6]. Наблюдайте появление синего окрашивания в центре капли и розового по ее окружности. Составьте схему действия гальванопары, возникающей при различной аэрации металлической поверхности. Чем вызвано появление розовой окраски у краев капли?
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.